الألكانات لفترة وجيزة. الألكانات: الخواص الكيميائية
الخصائص الفيزيائية للألكانات
في الظروف العادية، تكون الأعضاء الأربعة الأولى في سلسلة الألكانات المتماثلة (C1 - C4) غازات. الألكانات العادية من البنتان إلى السباعيكان (C5 - C17) هي سوائل، ابتداء من C18 فما فوق تكون مواد صلبة. مع زيادة عدد ذرات الكربون في السلسلة، أي. مع زيادة الوزن الجزيئي النسبي، تزداد نقاط الغليان والانصهار للألكانات.
مع وجود نفس العدد من ذرات الكربون في الجزيء، تكون للألكانات المتفرعة نقاط غليان أقل من الألكانات العادية.
الألكانات غير قابلة للذوبان عمليا في الماء، وذلك لأن جزيئاتها منخفضة القطبية ولا تتفاعل مع جزيئات الماء. تمتزج الألكانات السائلة بسهولة مع بعضها البعض. تذوب جيدًا في المذيبات العضوية غير القطبية مثل البنزين ورابع كلوريد الكربون وما إلى ذلك.
بناء
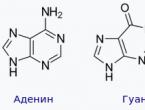
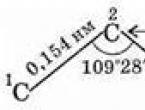
جزيء أبسط ألكان - الميثان - له شكل رباعي السطوح منتظم، في وسطه توجد ذرة كربون، وفي القمم توجد ذرات الهيدروجين. الزوايا بين محاور روابط C-H هي 109°28" (الشكل 29).
في جزيئات الهيدروكربونات المشبعة الأخرى، الزوايا بين الروابط (كل من C-H وCC) لها نفس المعنى. يستخدم لوصف شكل الجزيئات مفهوم تهجين المدارات الذرية(انظر الجزء الأول، §6).
في الألكانات، جميع ذرات الكربون موجودة في الحالة س 3 -التهجين (الشكل 30).
وبالتالي، فإن ذرات الكربون في سلسلة الكربون ليست في خط مستقيم. المسافة بين ذرات الكربون المجاورة (بين نوى الذرات) ثابتة تمامًا - وهذا هو الحال طول الرابطة الكيميائية(0.154 نانومتر). المسافة ج 1 - ج 3، ج 2 - ج 4، إلخ. (من خلال ذرة واحدة) ثابتة أيضًا، لأن الزاوية بين الروابط ثابتة - زاوية السندات.

يمكن أن تتغير المسافات بين ذرات الكربون البعيدة (ضمن حدود معينة) نتيجة للدوران حول روابط s. هذا الدوران لا يعطل تداخل المدارات التي تشكل الرابطة s، لأن هذه الرابطة لها تناظر محوري.


تسمى الأشكال المكانية المختلفة لجزيء واحد يتكون من دوران مجموعات الذرات حول الروابط s المطابقات(الشكل 31).
تختلف التشكلات في الطاقة، لكن هذا الاختلاف صغير (12-15 كيلوجول/مول). تكون أشكال الألكانات التي تكون فيها الذرات متباعدة قدر الإمكان أكثر استقرارًا (تنافر الأغلفة الإلكترونية). يتم الانتقال من شكل إلى آخر بسبب طاقة الحركة الحرارية. لتصوير التشكل، يتم استخدام الصيغ المكانية الخاصة (صيغ نيومان).
لا تخلط!
ومن الضروري التمييز بين مفهومي التشكل والتكوين.
يمكن أن تتحول المطابقات المختلفة إلى بعضها البعض دون كسر الروابط الكيميائية. لتحويل جزيء ذو تكوين معين إلى جزيء ذو تكوين آخر يتطلب كسر الروابط الكيميائية.
من أربعة أنواع الأيزومريةتتميز الألكانات بخاصيتين: تصاوغ الهيكل الكربوني وتصاوغه البصري (انظر الجزء 1).
الروابط الكيميائية في الألكانات، وكسرها وتكوينها يحدد الخواص الكيميائية للألكانات. روابط CC وCH هي روابط تساهمية وبسيطة (s-bonds)، وغير قطبية عمليًا، وقوية جدًا، وبالتالي:
1) تدخل الألكانات في أغلب الأحيان في تفاعلات تنطوي على انقسام الروابط الانحلالية.
2) مقارنة بالمركبات العضوية من الفئات الأخرى، تتميز الألكانات بتفاعلية منخفضة (ولهذا يطلق عليها اسم البارافينات- "خالية من الخصائص"). وبالتالي، فإن الألكانات مقاومة لعمل المحاليل المائية للأحماض والقلويات والعوامل المؤكسدة (مثل برمنجنات البوتاسيوم) حتى عند غليها.
لا تتفاعل الألكانات مع إضافة جزيئات أخرى إليها، وذلك لأنها لا تحتوي الألكانات على روابط متعددة في جزيئاتها.
تخضع الألكانات للتحلل تحت تسخين قوي في وجود محفزات على شكل بلاتين أو نيكل، ويتم التخلص من الهيدروجين من الألكانات.
يمكن أن تخضع الألكانات لتفاعلات الأيزومرة. رد فعلهم النموذجي هو رد فعل الاستبدال,المضي قدما من خلال آلية جذرية.
الخواص الكيميائية
ردود فعل النزوح الجذرية
على سبيل المثال، النظر في تفاعل الألكانات مع الهالوجينات.يتفاعل الفلور بقوة شديدة (عادة مع انفجار) - في هذه الحالة، يتم كسر جميع روابط C-H وCC، ونتيجة لذلك، يتم تشكيل مركبات CF 4 وHF. رد الفعل ليس له أهمية عملية. لا يتفاعل اليود مع الألكانات. تحدث التفاعلات مع الكلور أو البروم إما بالضوء أو بالحرارة القوية؛ وفي هذه الحالة يحدث تكوين ألكانات أحادية إلى متعددة الهالوجين مستبدلة، على سبيل المثال:
CH 3 -CH 3 +Cl 2 ® hv CH 3 -CH 2 -Cl+HCl
يستمر تكوين مشتقات هالوجين الميثان من خلال سلسلة الجذور الحرةآلية. تحت تأثير الضوء، تنقسم جزيئات الكلور إلى جذور غير عضوية:
جذري غير عضوي Cl. يستخرج ذرة الهيدروجين بإلكترون واحد من جزيء الميثان، مكونًا HC1 والجذر الحر CH3
![]()
يتفاعل الجذر الحر مع جزيء الكلور Cl2، مكونًا مشتق الهالوجين وجذر الكلور.
![]()
يبدأ تفاعل الأكسدة بتجريد ذرة الهيدروجين بواسطة جزيء الأكسجين (وهو ثنائي الجذر) ثم يستمر كتفاعل متسلسل متفرع. يزداد عدد الجذور أثناء التفاعل. العملية مصحوبة
من خلال إطلاق كمية كبيرة من الحرارة، لا يتم كسر روابط C-H فقط، ولكن أيضًا روابط CC-C، ونتيجة لذلك، يتم تشكيل أول أكسيد الكربون (IV) والماء. قد يستمر التفاعل على شكل احتراق أو يؤدي إلى انفجار.
2С ن Н2 ن+2 +(3ن+1)О 2 ®2nСО 2 +(2ن+2)Н 2 O
في درجات الحرارة العادية، لا يحدث تفاعل الأكسدة؛ يمكن أن يبدأ إما عن طريق الاشتعال أو عن طريق التفريغ الكهربائي.
مع التسخين القوي (أكثر من 1000 درجة مئوية)، تتحلل الألكانات تمامًا إلى الكربون والهيدروجين. ويسمى رد الفعل هذا الانحلال الحراري.
CH 4 ® 1200 درجة مئوية + 2H 2
عن طريق الأكسدة الخفيفة للألكانات، وخاصة الميثان، مع الأكسجين الجوي في وجود محفزات مختلفة، يمكن الحصول على كحول الميثيل والفورمالدهيد وحمض الفورميك.

إذا مر الميثان عبر منطقة ساخنة بسرعة كبيرة ثم تم تبريده على الفور بالماء، فإن النتيجة هي الأسيتيلين.
هذا التفاعل هو أساس التوليف الصناعي الذي يسمى تكسير(التحلل غير الكامل) للميثان.
يتم تكسير متجانسات الميثان عند درجة حرارة أقل (حوالي 600 درجة مئوية). على سبيل المثال، يتضمن تكسير البروبان المراحل التالية:

لذا فإن تكسير الألكانات يؤدي إلى تكوين خليط من الألكانات والألكانات ذات الوزن الجزيئي الأقل.
يؤدي تسخين الألكانات إلى 300-350 درجة مئوية (لم يحدث التشقق بعد) في وجود محفز (Pt أو Ni) إلى نزع الهيدروجين- إزالة الهيدروجين.

عندما يؤثر حمض النيتريك المخفف على الألكانات عند درجة حرارة 140 درجة مئوية وضغط منخفض، يحدث تفاعل جذري:
CH 3 -CH 3 + HNO 3 ®CH 3 -CH 2 -NO 2 + H 2 O الأيزوميرة
في ظل ظروف معينة، يمكن أن تتحول الألكانات العادية إلى ألكانات ذات سلسلة متفرعة.
تحضير الألكانات
لنفكر في إنتاج الألكانات باستخدام مثال إنتاج الميثان. الميثان منتشر على نطاق واسع في الطبيعة. وهو المكون الرئيسي للعديد من الغازات القابلة للاشتعال، سواء الطبيعية (90-98٪) أو الاصطناعية، التي يتم إطلاقها أثناء التقطير الجاف للخشب والجفت والفحم، وكذلك أثناء تكسير النفط. تحتوي الغازات الطبيعية، وخاصة الغازات المصاحبة من حقول النفط، على الإيثان والبروبان والبيوتان والبنتان بالإضافة إلى الميثان.
يتم إطلاق الميثان من قاع المستنقعات ومن طبقات الفحم في المناجم، حيث يتشكل أثناء التحلل البطيء لحطام النباتات دون الوصول إلى الهواء. لذلك، يُطلق على الميثان غالبًا اسم غاز المستنقعات أو مصباح النار.
يتم إنتاج الميثان في المختبر عن طريق تسخين خليط من خلات الصوديوم وهيدروكسيد الصوديوم:
CH 3 COONa + NaOH® 200 ° نا 2 كو 3 + سي إتش 4
أو عندما يتفاعل كربيد الألومنيوم مع الماء: Al 4 Cl 3 +12H 2 O®4Al(OH) 3 +3CH 4
وفي الحالة الأخيرة، تبين أن الميثان نقي للغاية.
يمكن إنتاج الميثان من مواد بسيطة عن طريق التسخين في وجود عامل محفز:
ج + 2 ح 2 ® Ni CH 4 8 أيضًا عن طريق التوليف المعتمد على غاز الماء
CO + 3H 2 ® Ni CH 4 + H 2 O
هذه الطريقة ذات أهمية صناعية. ومع ذلك، عادة ما يتم استخدام الميثان الناتج عن الغازات الطبيعية أو الغازات المتكونة أثناء فحم الفحم وأثناء تكرير النفط.
يتم الحصول على متجانسات الميثان، مثل الميثان، في ظروف المختبر عن طريق تكليس أملاح الأحماض العضوية المقابلة مع القلويات. طريقة أخرى هي رد فعل فورتز، أي. تسخين مشتقات الهالوجين الأحادي مع معدن الصوديوم، مثلاً:
C 2 H 5 Br+2Na+BrC 2 H 6 ® C 2 H 5 -C 2 H 5 +2NaBr
في التكنولوجيا، يتم استخدام التوليف لإنتاج البنزين التقني (خليط من الهيدروكربونات يحتوي على 6-10 ذرات كربون).
من أول أكسيد الكربون (II) والهيدروجين في وجود محفز (مركب الكوبالت) وتحت ضغط مرتفع. عملية
يمكن التعبير عنها بالمعادلة
nСО+(2n+1)Н 2 ® 200° C n H 2n+2 +nН 2 O
لذا فإن المصادر الرئيسية للألكانات هي الغاز الطبيعي والنفط. ومع ذلك، يتم تصنيع بعض الهيدروكربونات المشبعة من مركبات أخرى.
تطبيقات الألكانات
تستخدم معظم الألكانات كوقود. تكسير و
يؤدي نزع الهيدروجين إلى تكوين هيدروكربونات غير مشبعة، والتي
والتي يتم الحصول منها على العديد من المواد العضوية الأخرى.
الميثان هو الجزء الرئيسي من الغازات الطبيعية (60-99٪). جزء
وتشمل الغازات الطبيعية البروبان والبيوتان. الهيدروكربونات السائلة
يستخدم كوقود في محركات الاحتراق الداخلي والسيارات والطائرات وغيرها. خليط من السوائل المنقى
والألكانات الصلبة تشكل الفازلين. الألكانات الأعلى موجودة
المواد الأولية لإنتاج المنظفات الاصطناعية. تستخدم الألكانات التي تم الحصول عليها عن طريق الأيزومرة في إنتاج البنزين والمطاط عالي الجودة. فيما يلي رسم تخطيطي لاستخدام الميثان

الألكانات الحلقية
بناء
الألكانات الحلقية هي هيدروكربونات مشبعة تحتوي جزيئاتها على حلقة مغلقة من ذرات الكربون.
تشكل الألكانات الحلقية (البارافينات الحلقية) سلسلة متجانسة ذات الصيغة العامة C n H 2 n، حيث يكون العضو الأول هو
البروبان الحلقي C3H6، لأن لتكوين حلقة، يجب أن تكون هناك ثلاث ذرات كربون على الأقل.
الألكانات الحلقية لها عدة أسماء: البارافينات الحلقية، النفثينات، السيكلانات، البولي ميثيلين. أمثلة على بعض الروابط:

الصيغة C n H 2 n هي سمة من سمات البارافينات الحلقية، وتصف الصيغة نفسها بالضبط سلسلة الألكينات المتماثلة (الهيدروكربونات غير المشبعة التي لها رابطة متعددة واحدة). من هذا يمكننا أن نستنتج أن كل ألكان حلقي هو إيزوميري مع ألكين مناظر - وهذا مثال على الأيزومرية "بين الطبقات".
تنقسم الألكانات الحلقية إلى عدد من المجموعات بناءً على حجم الحلقة، والتي سننظر فيها إلى دورتين: دورات صغيرة (C 3، C 4) وعادية (C 5 -C 7).
يتم إنشاء أسماء الألكانات الحلقية عن طريق إضافة البادئة cyclo- إلى اسم الألكان مع العدد المقابل من ذرات الكربون. يتم الترقيم في الدورة بحيث يحصل البدائل على أقل الأرقام.
عادة ما تتم كتابة الصيغ الهيكلية للألكانات الحلقية بشكل مختصر، باستخدام الشكل الهندسي للحلقة وحذف رموز ذرات الكربون والهيدروجين. على سبيل المثال:

يتم تحديد الأيزومرية الهيكلية للألكانات الحلقية من خلال حجم الحلقة (البيوتان الحلقي وميثيل البروبان الحلقي عبارة عن أيزومرات) وموضع البدائل في الحلقة (على سبيل المثال، 1،1 و 1،2 ثنائي ميثيل بيوتان)، بالإضافة إلى بنيتها. .
الأيزومرية المكانية هي أيضًا سمة من سمات الألكانات الحلقية، لأن ويرتبط بترتيبات مختلفة للبدائل بالنسبة لمستوى الحلقة. عندما يتم وضع البدائل على جانب واحد من المستوى الحلقي، يتم الحصول على أيزومرات مقرنة، ويتم الحصول على أيزومرات متحولة على الجانبين المتقابلين.
الهيدروكربونات المشبعة- هذه هي الهيدروكربونات التي تحتوي جزيئاتها على روابط بسيطة (مفردة) (-روابط). الهيدروكربونات المشبعة هي الألكانات والألكانات الحلقية.
تكون ذرات الكربون الموجودة في الهيدروكربونات المشبعة في حالة تهجين sp3.
الألكانات- الهيدروكربونات المشبعة، والتي يتم التعبير عن تركيبها بالصيغة العامة C نح 2ن+2. الألكانات هي هيدروكربونات مشبعة.
الايزومرات والمتماثلات
| ز | الفصل 4 الميثان |
||||
| الفصل 3 - الفصل 3 الإيثان |
|||||
| CH 3 -CH 2 -CH 3 البروبان |
|||||
| CH 3 —(CH 2) 2 —CH 3 البيوتان |
2- ميثيل بروبان |
||||
| CH 3 —(CH 2) 3 —CH 3 البنتان |
2-ميثيل بيوتان |
2,2-ثنائي ميثيل بروبان |
|||
| CH 3 —(CH 2) 4 —CH 3 الهكسان |
2- ميثيل بنتان |
2،2-ثنائي ميثيل البيوتان |
2,3-ثنائي ميثيل البيوتان |
3- ميثيل بنتان |
|
| نظائر | |||||
الخصائص الفيزيائية للألكانات
في درجة حرارة الغرفة، يكون C 1 -C 4 غازات، و C 5 -C 15 سوائل، و C 16 وما يلي مواد صلبة؛ غير قابل للذوبان في الماء؛ كثافة أقل من 1 جم/سم3؛ سائل - برائحة البنزين.
كلما زاد عدد ذرات الكربون في الجزيء، زادت درجة الغليان.
الخواص الكيميائية للألكانات
نشاطه منخفض في الظروف العادية، لا يتفاعل مع محاليل الأحماض والقلويات، لا يتغير لون محلول KMnO 4 وماء البروم.
>تحضير الألكانات
>>الألكانات الحلقية- الهيدروكربونات المشبعة، والتي يتم التعبير عن تركيبها بالصيغة C نح 2 ن. تحتوي جزيئات الألكان الحلقي على سلاسل كربون مغلقة (دورات).
الايزومرات والمتماثلات
| ز | السيكلوبروبان C3H6 أو |
||||
| سيكلوبوتان C4H8 أو |
ميثيل سيكلوبروبان |
||||
| سيكلوبنتان C5H10 أو |
ميثيل سيكلوبوتان |
1،1-ثنائي ميثيل حلقي البروبان |
1,2-ثنائي ميثيل حلقي البروبان |
إيثيل سيكلوبروبان |
|
| نظائر | |||||
بشكل مبسط، غالبًا ما يتم تصوير دورة الهيدروكربون على أنها مضلع منتظم مع العدد المناسب من الزوايا.
تختلف الخصائص الفيزيائية قليلاً عن تلك الخاصة بالألكانات.
الخواص الكيميائية
باستثناء البروبان الحلقي والبيوتان الحلقي، تكون الألكانات الحلقية، مثل الألكانات، غير نشطة في الظروف العادية.
الخصائص العامة للألكانات الحلقية (باستخدام الهكسان الحلقي كمثال):
>الخصائص الخاصة للبروبان الحلقي والبيوتان الحلقي (الميل إلى تفاعلات الإضافة):
طرق الحصول على الألكانات الحلقية
خوارزمية لتجميع أسماء الهيدروكربونات المشبعة
- أوجد العمود الفقري للكربون: فهو أطول سلسلة من ذرات الكربون.
- قم بترقيم ذرات الكربون في السلسلة الرئيسية، بدءًا من النهاية الأقرب إلى الفرع.
- وضح عدد ذرة الكربون في السلسلة الرئيسية التي لها بديل وأذكر اسم البديل. إذا كان هناك عدة بدائل، قم بترتيبها أبجديًا. قبل أسماء البدائل المتطابقة، قم بالإشارة إلى أعداد جميع ذرات الكربون المرتبطة بها واستخدم البادئات المضاعفة (di-، tri-، tetra-).
- اكتب اسم السلسلة الرئيسية باللاحقة -an. جذور أسماء السلسلة الرئيسية: ج 1 - التقى، ج 2 - وآخرون، ج 3 - الدعامة، ج 4 - لكن، ج 5 - المكبوتة، ج 6 - سداسي، ج 7 - الكبد، ج 8 - طيب، ج9 - غير، من 10 - ديسمبر يتم تشكيل أسماء الألكانات الحلقية غير المستبدلة من اسم الهيدروكربون المشبع مع إضافة البادئة cyclo-. إذا كانت هناك بدائل في الألكان الحلقي، فسيتم ترقيم ذرات الكربون في الحلقة من البديل الأبسط (الأقدم، الميثيل) إلى الأكثر تعقيدًا بأقصر طريقة، ويتم الإشارة إلى مواضع البدائل بنفس الطريقة كما في الألكانات.
مهام واختبارات حول موضوع "الموضوع 1. "الهيدروكربونات المشبعة"."
- الهيدروكربونات. البوليمرات - المواد العضوية درجة 8-9
الدروس: 7 واجبات: 9 اختبارات: 1
- - الإنسان في عالم المواد والمواد والتفاعلات الكيميائية، الصفوف 8-9
الدروس: 2 الواجبات: 6 الاختبارات: 1
- تصنيف المواد - فئات المواد غير العضوية الصف 8-9
الدروس: 2 الواجبات: 9 الاختبارات: 1
أ.بالنظر إلى خصائص مادة واحدة مشاركة في التفاعل (الكتلة والحجم وكمية المادة)، تحتاج إلى العثور على خصائص مادة أخرى.مثال.أوجد كتلة الكلور اللازمة لكلورة المرحلة الأولى البالغة 11.2 لترًا من الميثان.
إجابة: م(Cl2) = 35.5 جم.
ب.الحسابات باستخدام قاعدة النسب الحجمية للغازات.
مثال.تحديد حجم الأكسجين، المقاس في الظروف العادية (n.o.)، الذي سيكون مطلوبًا للاحتراق الكامل لـ 10 م 3 من البروبان (n.o.).
إجابة: الخامس(يا2) = 50 م3.بعد التأكد من إتقان كل ما تحتاجه، انتقل إلى إكمال المهام الخاصة بالموضوع 1. نتمنى لك التوفيق.
اقتراحات للقراءة:- O. S. Gabrielyan وآخرون الكيمياء الصف العاشر. م.، الحبارى، 2002؛
- L. S. Guzey، R. P. Surovtseva، G. G. Lysova. الكيمياء الصف الحادي عشر. الحبارى، 1999.
- جي جي ليسوفا. الملاحظات والاختبارات الأساسية في الكيمياء العضوية. م.، جليك بلس ذ.م.م، 1999.
الهيدروكربونات المشبعة هي مركبات عبارة عن جزيئات تتكون من ذرات الكربون في حالة تهجين sp3. ترتبط ببعضها البعض حصريًا بواسطة روابط سيجما التساهمية. يأتي اسم الهيدروكربونات "المشبعة" أو "المشبعة" من حقيقة أن هذه المركبات ليس لديها القدرة على ربط أي ذرات. فهي متطرفة، مشبعة تماما. الاستثناء هو الألكانات الحلقية.
ما هي الألكانات؟
الألكانات عبارة عن هيدروكربونات مشبعة، وسلسلة الكربون الخاصة بها مفتوحة وتتكون من ذرات كربون متصلة ببعضها البعض باستخدام روابط مفردة. ولا يحتوي على روابط أخرى (أي مزدوجة، مثل الألكينات، أو ثلاثية، مثل الألكيلات). وتسمى الألكانات أيضًا بالبرافينات. لقد حصلوا على هذا الاسم لأن البارافينات المعروفة هي خليط من هذه الهيدروكربونات المشبعة في الغالب C 18 -C 35 مع خمول خاص.
معلومات عامة عن الألكانات وجذورها
صيغتهم: C n P 2 n +2، هنا n أكبر من أو يساوي 1. يتم حساب الكتلة المولية باستخدام الصيغة: M = 14n + 2. السمة المميزة: النهايات في أسمائهم هي "-an". وتسمى بقايا جزيئاتها، التي تتشكل نتيجة استبدال ذرات الهيدروجين بذرات أخرى، بالجذور الأليفاتية، أو الألكيلات. يتم تحديدها بالحرف R. الصيغة العامة للجذور الأليفاتية أحادية التكافؤ: C n P 2 n +1، هنا n أكبر من أو يساوي 1. يتم حساب الكتلة المولية للجذور الأليفاتية بواسطة الصيغة: M = 14n + 1. السمة المميزة للجذور الأليفاتية: النهايات في الأسماء "- الطمي". تتميز جزيئات الألكان بخصائصها الهيكلية الخاصة:
- تتميز رابطة CC بطول 0.154 نانومتر؛
- تتميز رابطة CH بطول 0.109 نانومتر؛
- زاوية الرابطة (الزاوية بين روابط الكربون والكربون) هي 109 درجة و28 دقيقة.

تبدأ الألكانات بسلسلة متماثلة: الميثان، والإيثان، والبروبان، والبيوتان، وهكذا.
الخصائص الفيزيائية للألكانات
الألكانات هي مواد عديمة اللون وغير قابلة للذوبان في الماء. تزداد درجة الحرارة التي تبدأ عندها الألكانات في الذوبان ودرجة الحرارة التي تغلي عندها وفقًا للزيادة في الوزن الجزيئي وطول السلسلة الهيدروكربونية. من الألكانات الأقل تفرعًا إلى الألكانات الأكثر تفرعًا، تنخفض نقاط الغليان والانصهار. يمكن أن تحترق الألكانات الغازية بلهب أزرق شاحب أو عديم اللون وتنتج قدرًا كبيرًا من الحرارة. CH 4 -C 4 H 10 هي غازات ليس لها رائحة أيضًا. C 5 H 12 -C 15 H 32 هي سوائل لها رائحة معينة. C 15 H 32 وهكذا هي مواد صلبة عديمة الرائحة أيضًا.
الخواص الكيميائية للألكانات
هذه المركبات غير نشطة كيميائيًا، وهو ما يمكن تفسيره بقوة روابط سيجما التي يصعب كسرها - CC وCH. ومن الجدير بالذكر أيضًا أن روابط CC غير قطبية، وسندات CH منخفضة القطبية. هذه هي أنواع الروابط منخفضة الاستقطاب التي تنتمي إلى نوع سيجما، وبالتالي، من المرجح أن يتم كسرها بواسطة آلية متجانسة، ونتيجة لذلك سيتم تشكيل الجذور. وبالتالي، فإن الخواص الكيميائية للألكانات تقتصر بشكل أساسي على تفاعلات الاستبدال الجذري.

تفاعلات النتروجين
تتفاعل الألكانات فقط مع حمض النيتريك بتركيز 10% أو مع أكسيد النيتروجين رباعي التكافؤ في بيئة غازية عند درجة حرارة 140 درجة مئوية. يسمى تفاعل نترات الألكانات بتفاعل كونوفالوف. ونتيجة لذلك، يتم تشكيل مركبات النيترو والماء: CH 4 + حمض النيتريك (المخفف) = CH 3 - NO 2 (نيتروميثان) + ماء.
تفاعلات الاحتراق
غالبًا ما تستخدم الهيدروكربونات المشبعة كوقود، وهو ما يبرره قدرتها على الاحتراق: C n P 2n+2 + ((3n+1)/2) O 2 = (n+1) H 2 O + n CO 2.
تفاعلات الأكسدة
تشمل الخصائص الكيميائية للألكانات أيضًا قدرتها على الأكسدة. اعتمادًا على الظروف المصاحبة للتفاعل وكيفية تغييرها، يمكن الحصول على منتجات نهائية مختلفة من نفس المادة. الأكسدة الخفيفة للميثان مع الأكسجين في وجود محفز يسرع التفاعل ودرجة حرارة حوالي 200 درجة مئوية يمكن أن تؤدي إلى المواد التالية:
1) 2CH 4 (الأكسدة بالأكسجين) = 2CH 3 OH (كحول - ميثانول).
2) CH 4 (الأكسدة بالأكسجين) = CH 2 O (ألدهيد - ميثانال أو فورمالدهايد) + H 2 O.
3) 2CH 4 (الأكسدة بالأكسجين) = 2HCOOH (حمض الكربوكسيل - الميثان أو الفورميك) + 2H 2 O.

كما يمكن إجراء أكسدة الألكانات في وسط غازي أو سائل مع الهواء. تؤدي مثل هذه التفاعلات إلى تكوين كحولات دهنية أعلى وأحماض مقابلة.
العلاقة بالحرارة
عند درجات حرارة لا تتجاوز +150-250 درجة مئوية، ودائمًا في ظل وجود محفز، تحدث إعادة ترتيب هيكلية للمواد العضوية، والتي تتكون من تغيير في ترتيب اتصال الذرات. وتسمى هذه العملية الأيزومرية، والمواد الناتجة عن التفاعل تسمى الأيزومرات. وهكذا، من البوتان العادي يتم الحصول على الأيزومر الخاص به - الأيزوبيوتان. عند درجات حرارة تتراوح بين 300-600 درجة مئوية ووجود محفز، تنكسر روابط CH مع تكوين جزيئات الهيدروجين (تفاعلات نزع الهيدروجين)، وجزيئات الهيدروجين مع إغلاق سلسلة الكربون في دورة (تفاعلات التدوير أو الأرومات للألكانات) :
1) 2CH 4 = C 2 H 4 (إيثين) + 2H 2.
2) 2CH 4 = C 2 H 2 (إيثاين) + 3H 2.
3) C 7 H 16 (هيبتان عادي) = C 6 H 5 - CH 3 (تولوين) + 4 H 2.

تفاعلات الهالوجين
تتضمن مثل هذه التفاعلات إدخال الهالوجينات (ذراتها) في جزيء مادة عضوية، مما يؤدي إلى تكوين رابطة الهالوجين C. عندما تتفاعل الألكانات مع الهالوجينات، تتشكل مشتقات الهالوجين. رد الفعل هذا له ميزات محددة. وهي تسير وفقًا لآلية جذرية، ومن أجل البدء بها، من الضروري تعريض خليط الهالوجينات والألكانات للأشعة فوق البنفسجية أو تسخينها ببساطة. تسمح خصائص الألكانات بمواصلة تفاعل الهلجنة حتى يتم تحقيق الاستبدال الكامل بذرات الهالوجين. أي أن كلورة الميثان لن تنتهي في مرحلة واحدة وهي إنتاج كلوريد الميثيل. سوف يذهب التفاعل إلى أبعد من ذلك، وسيتم تشكيل جميع منتجات الاستبدال الممكنة، بدءا من الكلوروميثان وتنتهي برابع كلوريد الكربون. إن تعرض الألكانات الأخرى للكلور في ظل هذه الظروف سيؤدي إلى تكوين منتجات مختلفة ناتجة عن استبدال الهيدروجين بذرات كربون مختلفة. ستحدد درجة الحرارة التي يحدث عندها التفاعل نسبة المنتجات النهائية ومعدل تكوينها. كلما كانت السلسلة الهيدروكربونية للألكان أطول، كان التفاعل أسهل. أثناء عملية الهالوجين، سيتم استبدال ذرة الكربون الأقل هدرجة (الثالثية) أولاً. سوف يتفاعل الأول بعد كل الآخرين. سيحدث تفاعل الهالوجين على مراحل. في المرحلة الأولى، يتم استبدال ذرة هيدروجين واحدة فقط. لا تتفاعل الألكانات مع محاليل الهالوجين (ماء الكلور والبروم).

تفاعلات الكبريت
يتم أيضًا استكمال الخواص الكيميائية للألكانات من خلال تفاعل الكلورة الكبريتية (يُسمى تفاعل ريد). عند تعرضها للأشعة فوق البنفسجية، تكون الألكانات قادرة على التفاعل مع خليط من الكلور وثاني أكسيد الكبريت. ونتيجة لذلك، يتم تشكيل كلوريد الهيدروجين، وكذلك جذري الألكيل، الذي يضيف ثاني أكسيد الكبريت. والنتيجة هي مركب معقد يصبح مستقرًا بسبب احتجاز ذرة الكلور وتدمير جزيئها التالي: R-H + SO 2 + Cl 2 + الأشعة فوق البنفسجية = R-SO 2 Cl + HCl. تستخدم كلوريدات السلفونيل المتكونة نتيجة التفاعل على نطاق واسع في إنتاج المواد الخافضة للتوتر السطحي.
يتم الحصول على الألكانات من المنتجات البترولية والغاز الطبيعي والفحم. الاستخدام الرئيسي للألكانات هو كوقود. وتستخدم هذه المواد أيضًا في صناعة المذيبات ومستحضرات التجميل والأسفلت.
وصف
الألكانات هي فئة من الهيدروكربونات المشبعة أو المشبعة. وهذا يعني أن جزيئات الألكان تحتوي على أكبر عدد ممكن من ذرات الهيدروجين. الصيغة العامة لمركبات سلسلة الألكانات المتماثلة هي C n H 2n+2. تتكون أسماء المواد من الأرقام اليونانية واللاحقة -an.
تعتمد الخصائص الفيزيائية والكيميائية للألكانات على بنيتها. مع زيادة عدد ذرات الكربون في الجزيء، يحدث التحول من المواد الغازية إلى المركبات الصلبة.
الحالة الفيزيائية للألكانات حسب عدد ذرات الكربون:
- ج1-ج4- غازات؛
- من 5 إلى 15- السوائل؛
- من 16 - من 390- المواد الصلبة.
تحترق الغازات بلهب أزرق، وتطلق كمية كبيرة من الحرارة. الألكانات التي تحتوي على 18-35 ذرة كربون هي مواد شمعية لينة. شموع البارافين مصنوعة من خليطها.

أرز. 1. شموع البارافين.
مع زيادة الوزن الجزيئي في السلسلة المتماثلة، تزداد درجات الانصهار والغليان.
طلب
يتم عزل الألكانات من المعادن - النفط والغاز والفحم. في مراحل مختلفة من المعالجة يتم الحصول على البنزين والكيروسين وزيت الوقود. تستخدم الألكانات في الطب والتجميل والبناء.

أرز. 2. يحتوي الزيت على ألكانات سائلة.
يصف الجدول المجالات الرئيسية لتطبيق الهيدروكربونات المشبعة.
|
منطقة |
ما يستخدم |
كيف تستعمل |
|
صناعة الطاقة |
البنزين والكيروسين وزيت الوقود |
كوقود الصواريخ والمحركات |
|
الألكانات الغازية |
كغاز منزلي للطهي |
|
|
الصناعة الكيميائية |
الأثير البترولي (خليط من الأيزوبنتان والإيزوهكسان)، |
إنتاج المذيبات وزيوت التشحيم والتشريب |
|
إنتاج الفازلين (خليط من الألكانات السائلة)، الفازلين (خليط من الألكانات السائلة والصلبة)، الشموع، المنظفات، الورنيش، المينا، الصابون. كتشريب للمباريات. يستخدم في إنتاج الأحماض العضوية |
||
|
الألكانات المكلورة |
إنتاج الكحوليات والألدهيدات والأحماض |
|
|
التجميل |
الفازلين، الفازلين |
إنتاج المراهم |
|
كمادة دافعة لصنع الهباء الجوي |
||
|
إنتاج مستحضرات التجميل المرطبة |
||
|
بناء |
القطران (القطران) هو المنتج النهائي لتكرير النفط، ويحتوي على خليط من الألكانات والألكانات الحلقية والأرينات والمعادن واللافلزات |
لإنتاج الطرق الأسفلتية |
|
صناعة الورق واللب |
كمادة تشريب لورق التغليف |
|
|
الصناعات الغذائية |
إنتاج العلكة |

أرز. 3. القطران.
تستخدم الألكانات في صناعة المطاط، والأقمشة الاصطناعية، والبلاستيك، والمواد الخافضة للتوتر السطحي. ويستخدم غاز البروبان والبيوتان في صورة مسالة لإعادة تعبئة أسطوانات إطفاء الحرائق.
ماذا تعلمنا؟
لقد تعلمنا لفترة وجيزة عن تطبيقات الألكانات. تُستخدم الهيدروكربونات المشبعة في الحالات الغازية والسائلة والصلبة في الصناعات الكيميائية والغذائية والورقية والطاقة ومستحضرات التجميل والبناء. تُستخدم الألكانات لإنتاج المذيبات والدهانات والورنيشات والصابون والشموع والمراهم والأسفلت. ويستخدم البنزين والكيروسين وزيت الوقود، المكون من الألكانات السائلة، كوقود. تستخدم الألكانات الغازية في الحياة اليومية وفي إنتاج الهباء الجوي. المصادر الرئيسية للألكانات هي النفط والغاز الطبيعي والفحم.
محتوى المقال
الألكانات والألكانات الحلقية– الهيدروكربونات التي ترتبط فيها جميع ذرات الكربون ببعضها البعض وبذرات الهيدروجين بروابط بسيطة (مفردة). الألكانات (مرادفات - الهيدروكربونات المشبعة، الهيدروكربونات المشبعة، البارافينات) - الهيدروكربونات ذات الصيغة العامة C نح 2 ن+2 أين ن– عدد ذرات الكربون . البولي إيثيلين المألوف له نفس الصيغة، فقط الحجم نفهي كبيرة جدًا ويمكن أن تصل إلى عشرات الآلاف. بالإضافة إلى ذلك، يحتوي البولي إيثيلين على جزيئات ذات أطوال مختلفة. في الألكانات الحلقية، تشكل ذرات الكربون سلسلة مغلقة؛ إذا كانت هناك دورة واحدة، فإن صيغة الألكان الحلقي هي C نح 2 ن .
اعتمادا على ترتيب اتصال ذرات الكربون في السلسلة، تنقسم الألكانات إلى خطية ومتفرعة. وفقا لذلك، للألكانات مع ن 4- من الممكن وجود أكثر من مادة بنفس الصيغة. تسمى هذه المواد ايزومرات (من اليونانية. مشاكل– متساوون ومتطابقون وميروس – حصة، جزء.
أسماء الألكانات.
كلمة "ألكان" هي من نفس أصل كلمة "كحول" ( انظر أدناه). المصطلح القديم "البارافين" يأتي من الكلمة اللاتينية parum - ذات الصلة الصغيرة وغير المهمة والمتعلقة؛ تتميز البارافينات بتفاعلية منخفضة بالنسبة لمعظم الكواشف الكيميائية. العديد من البارافينات متجانسة. في سلسلة الألكانات المتماثلة، يختلف كل عضو لاحق عن العضو السابق بمجموعة ميثيلين واحدة CH 2. المصطلح يأتي من المتجانسات اليونانية - المقابلة، مماثلة.
التسمية (من اللات. التسميات- قائمة الأسماء) يتم إنشاء أسماء الألكانات وفقًا لقواعد معينة لا تكون دائمًا غامضة. لذا، إذا كانت هناك بدائل مختلفة في جزيء الألكان، فسيتم إدراجها حسب الترتيب الأبجدي في اسم الألكان. ومع ذلك، قد يختلف هذا الترتيب في لغات مختلفة. على سبيل المثال، سيتم تسمية الهيدروكربون CH 3 –CH(CH 3) –CH(C 2 H 5) –CH 2 –CH 2 –CH 3 وفقًا لهذه القاعدة بـ 2-ميثيل-3-إيثيلهكسان باللغة الروسية، وباللغة الروسية الإنجليزية 3-إيثيل-2-ميثيلهكسان…
وفقًا لاسم الهيدروكربون، تسمى جذور الألكيل أيضًا: ميثيل (CH 3 -)، إيثيل (C 2 H 5 -)، إيزوبروبيل (CH 3) 2 CH-، الثلاثاء- بوتيل C 2 H 5 –CH (CH 3)-، فرك- بوتيل (CH 3) 3 C-، إلخ. يتم تضمين جذور الألكيل ككل في تكوين العديد من المركبات العضوية. في الحالة الحرة، تكون هذه الجسيمات ذات الإلكترونات غير المتزاوجة نشطة للغاية.
بعض أيزومرات الألكانات لها أيضًا أسماء تافهة ( سم. أسماء المواد التافهة، على سبيل المثال الأيزوبيوتان (2-ميثيل بروبان)، الأيزوأوكتان (2،2،4-تريميثيلبنتان)، نيوبنتان (2،3-ديميثيلبروبان)، سكوالان (2،6،10،15،19،23-هيكسامثيل تيتراكوسان)، والتي الاسم يأتي من اللاتينية صرخة– سمك القرش (مشتق غير مشبع من السكوالان – السكوالين، وهو مركب مهم لعملية التمثيل الغذائي، تم اكتشافه لأول مرة في كبد سمك القرش). الاسم التافه لجذر البنتيل (C5H11) هو الأميل. انها تأتي من اليونانية. اميلون– النشا: كان يسمى في قديم الزمان كحول الأيزواميل C5H11OH (3-ميثيلبوتانول-1) “كحول الأميل للتخمر” لأنه يشكل أساس زيت الفيوسيل، ويتكون نتيجة التخمر المواد السكرية - منتجات التحلل المائي للنشا.
أبسط عضو في سلسلة cycloalkane C نح 2 ن– البروبان الحلقي ( ن= 3). يُطلق على متجانساتها اسم الألكانات مع إضافة البادئة "سيكلو" (سيكلوبوتان، سيكلوبنتان، إلخ). في الألكانات الحلقية، تكون الأيزومرية ممكنة بسبب وجود مجموعات ألكيل جانبية وموقعها في الحلقة. على سبيل المثال، الهكسان الحلقي، ميثيل حلقي البنتان، 1،1-، 1،2- و1،3-ثنائي ميثيل حلقي البيوتان، 1،1،2- و1،2،3-ثلاثي ميثيل حلقي البروبان هي متصاوغات.
يزداد عدد أيزومرات الألكان بشكل حاد مع زيادة عدد ذرات الكربون. يرد في الجدول أسماء بعض الألكانات، بالإضافة إلى العدد النظري لأيزومراتها المحتملة.
| معادلة | اسم | عدد الايزومرات | معادلة | اسم | عدد الايزومرات |
| الفصل 4 | الميثان | 1 | ج11ن24 | اندكان | 159 |
| ج2ح6 | الإيثان | 1 | ج12ن26 | دوديكان | 355 |
| ج3ح8 | البروبان | 1 | ج13ن28 | تريديكان | 802 |
| ج4ح10 | البيوتان | 2 | ج14ن30 | تيتراديكان | 1858 |
| ج5ح12 | البنتان | 3 | ج 15 ن 32 | بنتاديكان | 4347 |
| ج6ح14 | الهكسان | 5 | ج20 ن42 | إيكوسان | 366319 |
| ج7 ح16 | هيبتان | 9 | ج25 ن52 | بنتاكوسان | 36797588 |
| ج8ح18 | أوكتان | 18 | ج30 ن62 | ترياكوتان | 4111846763 |
| ج9ح20 | نونان | 35 | ج40 ن82 | تيتراكونتان | 62481801147341 |
| ج10 ح22 | عميد | 75 | ج100ن202 | الهكتان | حوالي 5.921 10 39 |
إن فهم معظم أسماء تسميات الهيدروكربونات المشبعة ليس بالأمر الصعب للغاية حتى بالنسبة لأولئك الذين لم يدرسوا اللغة اليونانية في صالة للألعاب الرياضية الكلاسيكية. تأتي هذه الأسماء من الأرقام اليونانية مع إضافة اللاحقة -an. يكون الأمر أكثر صعوبة مع الأعضاء الأوائل في السلسلة: فهم لا يستخدمون الأرقام، ولكن الجذور اليونانية الأخرى المرتبطة بأسماء الكحولات أو الأحماض المقابلة. كانت هذه الكحوليات والأحماض معروفة قبل وقت طويل من اكتشاف الألكانات المقابلة لها؛ ومن الأمثلة على ذلك الكحول الإيثيلي والإيثان (تم الحصول عليهما فقط في عام 1848).
الميثان (وكذلك الميثانول والميثيل والميثيلين وما إلى ذلك) له جذر مشترك "ميت" والذي يشير في الكيمياء إلى مجموعة تحتوي على ذرة كربون واحدة: ميثيل CH 3، ميثيلين (ميثيليدين) CH 2، ميثيلين (ميثيليدين) CH. تاريخيًا، كانت أول مادة من هذا القبيل هي كحول الميثيل (المعروف أيضًا باسم الخشب)، والميثانول، والذي تم الحصول عليه سابقًا عن طريق التقطير الجاف للخشب. يأتي اسمها من الكلمات اليونانية methy - لتسكر النبيذ والهيل - الغابة (إذا جاز التعبير "نبيذ الخشب"). الأمر المدهش هنا هو أن الميثان والجمشت والعسل لديهم جذر مشترك! في العصور القديمة، تم منح الأحجار الكريمة خصائص سحرية (وما زال الكثيرون يؤمنون بهذا). وهكذا كان يُعتقد أن أحجار الأرجوان الجميلة تحمي من التسمم، خاصة إذا كان كوب الشرب مصنوعًا من هذا الحجر. جنبا إلى جنب مع البادئة السلبية اتضح الجمشت - مكافحة التسمم. اتضح أن كلمة "عسل" موجودة في جميع اللغات الأوروبية تقريبًا: الإنجليزية. ميد - العسل (كمشروب)، ميت الألمانية (في الألمانية القديمة ميتو)، ميد هولندي، السويدية مجود، الدنماركية مجود، الليتوانية واللاتفية، ناهيك عن اللغات السلافية. كل هذه الكلمات، بما في ذلك اليونانية، تأتي من الكلمة الهندية الأوروبية medhu، والتي تعني المشروب الحلو. البراندي اليوناني ميتاكسا ليس بعيدًا عنهم، على الرغم من أنه ليس حلوًا على الإطلاق.
الإيثان (وكذلك الأثير والإيثانول والكحول والألكان) له أصل مشترك. استخدم فلاسفة اليونان القدماء كلمة "أي" لوصف مادة معينة تتخلل الكون. عندما الكيميائيين في القرن الثامن. لقد حصلوا على سائل يتبخر بسهولة من كحول النبيذ وحمض الكبريتيك، وكان يسمى الأثير الكبريتي. في القرن 19 اكتشف أن الأثير الكبريتي (في الأثير الإنجليزي) ينتمي إلى ما يسمى بالإثيرات ويحتوي على مجموعة من ذرتي كربون - مثل الكحول الإيثيلي (الإيثانول) ؛ هذه المجموعة كانت تسمى الإيثيل. وبالتالي فإن اسم المادة "إيثر الإيثيل" (C2H5 –O–C2H5) هو في الأساس "زيت الزيت".
اسم الإيثان يأتي من "الإيثيل". أحد أسماء الإيثانول، الكحول، هو من نفس أصل كلمة ألكان (أيضا ألكين، ألكاين، ألكيل). والكحل في اللغة العربية يعني مسحوق، مسحوق، غبار. مع أدنى نفس، يرتفعون في الهواء، وكذلك أبخرة النبيذ - "كحول النبيذ"، والذي تحول بمرور الوقت إلى كحول.
لماذا يوجد حرف "t" في "الإيثان" و"الإيثانول"، و"f" في "الأثير"؟ بعد كل شيء، في اللغة الإنجليزية، على عكس اللغة الروسية، فإن الكلمات "الأثير" و "الإيثيل" لها هجاء وأصوات متشابهة. يعود الجمع إلى الحرف اليوناني q (ثيتا)؛ في اللغة الروسية حتى عام 1918، كان للحرف "fita" نفس الأسلوب، والذي تم نطقه كـ "f" وكان يستخدم لغرض وحيد هو تمييز الكلمات التي يأتي فيها هذا الحرف من الحرف اليوناني q و 247 (" فاي"). وفي لغات أوروبا الغربية، اليونانية. ذهب j إلى الرقم الهيدروجيني، و q إلى ال. في اللغة الروسية، تحتوي العديد من الكلمات على كلمة "fita" في القرن الثامن عشر. تم استبداله بالحرف "f": المسرح بدلاً من "قفتر"، والرياضيات بدلاً من "المقاميات"، والنظرية بدلاً من "qeory"... ومن المثير للاهتمام في هذا الصدد أنه في قاموس دال، الذي نُشر عام 1882، هو إكير مكتوب، وفي القاموس الموسوعي لبروكهاوس وإيفرون (1904) - "الأثير".
وبالمناسبة فإن الإسترات في اللغات الغربية هي إستر وليست أثير. لكن كلمة "استر" غير موجودة في اللغة الروسية، لذلك تتأذى عيون أي كيميائي من الترجمة الأمية للبوليستر الإنجليزي على ملصقات المنتجات النسيجية على أنها "بوليستر" بدلاً من "بوليستر"، "ألياف البوليستر" (البوليستر). تشمل، على سبيل المثال، لافسان، تيريلين، الداكرون).
تأتي أسماء "البروبان" و"البيوتان" من أسماء الأحماض المقابلة - البروبيونيك والبوتانويك (الزبدي). حمض البروبيونيك هو "الأول" (أي أقصر سلسلة) الموجود في الدهون ( سم. الدهون والزيوت)، واسمها مشتق من اليونانية. بروتوس- أولا و بيون- سمين. البيوتان وحمض البيوتانويك زبدي حامض) - من اليونانية. بوتيرون- زيت؛ في اللغة الروسية، الزبدات هي أملاح واسترات حمض الزبد. يتم إطلاق هذا الحمض عندما يصبح الزيت زنخًا.
علاوة على ذلك، بدءًا من البنتان، فإن الأسماء مشتقة من الأرقام اليونانية. الاستثناء النادر هو السيتان، وهو أحد أسماء سداسي الـC16. تأتي هذه الكلمة من اسم كحول سيتيل الذي حصل عليه الكيميائي الفرنسي ميشيل يوجين شيفرول عام 1823. قام شيفريول بعزل هذه المادة من سبيرماسيتي، وهي مادة شمعية من رأس حوت العنبر. كلمة سبيرماسيتي تأتي من الكلمة اليونانية سبيرما - البذور والكيتوس - حيوان بحري كبير (الحوت، الدلفين). من التهجئة اللاتينية للكلمة الثانية (cetus) يأتي كحول سيتيل C 16 H 33 OH (هيكساديكانول) وسيتان.
في اللغة الروسية هناك العديد من الكلمات التي لها نفس جذور الألكانات: البنتاغون، السباعي (مقياس صوتي من 7 خطوات)، دوديكافوني (طريقة التأليف الموسيقي)، الأوكتاف، العشري والعشري (الفواصل الموسيقية)، الثماني والنونيت (مجموعات من 8 و 9 موسيقيين)، الخماسي، السداسي والسباعي (أنابيب الراديو)؛ السداسي (المقياس الشعري)، المجسم الثماني، العقد، العشرية، الهكتار، أكتوبر، ديسمبر، إلخ. وما إلى ذلك وهلم جرا.
تم تصنيع الألكان الذي يحتوي على أطول الجزيئات من قبل الكيميائيين الإنجليز في عام 1985. وهو غير كونتاتريكتان C 390 H 782، ويحتوي على سلسلة من 390 ذرة كربون. كان الباحثون مهتمين بكيفية تجميع هذه السلاسل الطويلة أثناء التبلور (يمكن طي سلاسل الهيدروكربون المرنة بسهولة).
عدد ايزومرات الألكانات.
تم حل مشكلة العدد المحتمل نظريًا لأيزومرات الألكانات لأول مرة من قبل عالم الرياضيات الإنجليزي آرثر كايلي (1821-1895)، أحد مؤسسي فرع مهم من الرياضيات - الطوبولوجيا (في عام 1879 نشر أول مقال عن "الشهير" "مشكلة الألوان الأربعة": هل يوجد منها ما يكفي لتلوين أي بطاقة جغرافية، ولم يتم حل هذه المشكلة إلا في عام 1976). اتضح أنه لا توجد صيغة يمكن من خلالها استخدام عدد ذرات الكربون في ألكان C نح 2 ن+2 حساب عدد ايزومراته. لا يوجد سوى ما يسمى بالصيغ المتكررة (من اللاتينية التكرارات– العودة) والتي تسمح لك بحساب عدد الايزومرات نالعضو الرابع في السلسلة إذا كان عدد أيزومرات العضو السابق معروفا بالفعل. ولذلك، حسابات كبيرة نتم الحصول عليها مؤخرًا نسبيًا باستخدام أجهزة الكمبيوتر وتم تخفيضها إلى الهيدروكربون C 400 H 802؛ لذلك، مع الأخذ في الاعتبار الأيزومرات المكانية، تم الحصول على قيمة يصعب تخيلها: 4.776·10 199. وبدءا من الألكان C 167 H 336 فإن عدد الأيزومرات يفوق عدد الجسيمات الأولية في الجزء المرئي من الكون والذي يقدر بـ 10 80. سيزداد عدد الأيزومرات المشار إليها في الجدول لمعظم الألكانات بشكل ملحوظ إذا أخذنا في الاعتبار أيضًا جزيئات متناظرة مرآة - أيزومرات مجسمة ( سم. الأيزومرية البصرية): للهيبتان - من 9 إلى 11، للديكان - من 75 إلى 136، للإيكوزان - من 366319 إلى 3396844، للهكتان - من 5.921 10 39 إلى 1.373 10 46، إلخ.
من وجهة نظر الكيميائي، فإن عدد الأيزومرات الهيكلية للهيدروكربونات المشبعة له أهمية عملية فقط للأعضاء الأوائل في السلسلة. حتى بالنسبة لألكان بسيط نسبيًا يحتوي على دستة ونصف فقط من ذرات الكربون، لم يتم الحصول على العدد الهائل من الأيزومرات ومن غير المرجح أن يتم تصنيعها على الإطلاق. على سبيل المثال، تم تصنيع آخر أيزومرات الديكان الـ 75 الممكنة نظريًا فقط في عام 1968. وقد تم ذلك لأغراض عملية - للحصول على مجموعة أكثر اكتمالاً من المركبات القياسية التي يمكن من خلالها للهيدروكربونات المختلفة، على سبيل المثال، تلك الموجودة في النفط، الكشف عن هويته. بالمناسبة، تم العثور على جميع أيزومرات الأوكتان الثمانية عشر المحتملة في أنواع مختلفة من الزيت.
لكن الشيء الأكثر إثارة للاهتمام هو أنه، بدءًا من سباعيديكان C 17 H 36، في البداية فقط بعض العدد الممكن نظريًا من الأيزومرات، ثم الكثير منها، وفي النهاية كلها تقريبًا هي مثال صارخ على "كيمياء الورق"، أي. لا يمكن أن توجد في الواقع. والحقيقة هي أنه مع زيادة عدد ذرات الكربون في جزيئات الأيزومرات المتفرعة، تنشأ مشاكل خطيرة تتعلق بالتعبئة المكانية. ففي نهاية المطاف، تعامل علماء الرياضيات مع ذرات الكربون والهيدروجين كنقاط، في حين أن لها في الواقع نصف قطر محدود. وبالتالي، فإن "كرة" الميثان تحتوي على 4 ذرات هيدروجين على "سطحها"، والتي يتم وضعها بحرية عليها. في نيوبنتان C(CH 3) 4 توجد بالفعل 12 ذرة هيدروجين على "السطح"، وتقع بالقرب من بعضها البعض؛ ولكن لا يزال هناك مجال لوضعها. لكن بالنسبة للألكان 4 (C17H36)، لا توجد مساحة كافية على السطح لاستيعاب جميع ذرات الهيدروجين الـ 36 الموجودة في 12 مجموعة ميثيل؛ من السهل التحقق من ذلك إذا قمت برسم صورة مسطحة (أو الأفضل من ذلك، إنشاء نموذج ثلاثي الأبعاد من البلاستيسين وأعواد الثقاب) لأيزومرات مماثلة، مع الحفاظ على ثبات أطوال الروابط C–C وC–H وجميع الزوايا بينهما. هم). مع النمو نتنشأ مشاكل التنسيب أيضًا لذرات الكربون. ونتيجة لذلك، على الرغم من أن عدد الايزومرات المحتملة يتزايد نيزداد بسرعة كبيرة، وتنمو حصة الأيزومرات "الورقية" بشكل أسرع بكثير. وأظهر التقييم القائم على الكمبيوتر أن نإن نسبة عدد الأيزومرات الممكنة حقًا إلى عدد الأيزومرات "الورقية" تقترب بسرعة من الصفر. وهذا هو السبب في حساب العدد الدقيق لأيزومرات الهيدروكربونات المشبعة الكبيرة نالتي أثارت اهتمامًا كبيرًا في السابق، أصبحت الآن ذات أهمية نظرية فقط بالنسبة للكيميائيين.
الهيكل والخصائص الفيزيائية للألكانات.
تحتوي الألكانات على أربعة مدارات هجينة sp 3 لذرة الكربون ( سم. المدارات) موجهة نحو رؤوس رباعي الاسطح بزاوية بينهما حوالي 109°28" - في هذه الحالة يكون التنافر بين الإلكترونات وطاقة النظام في حده الأدنى. ونتيجة لتداخل هذه المدارات مع بعضهم البعض، وكذلك مع س- مدارات ذرات الهيدروجين تشكل روابط s C-C و C-H. هذه الروابط في جزيئات الألكان تكون تساهمية غير قطبية أو منخفضة القطبية.
تنقسم الألكانات إلى ذرات كربون أولية (مرتبطة بذرة C واحدة فقط مجاورة)، وثانوية (مرتبطة بذرتين C)، وثلاثية (مرتبطة بثلاث ذرات C)، ورباعية (مرتبطة بأربع ذرات C). وهكذا، في 2،2-ثنائي ميثيل -3-ميثيل بنتان CH 3 –C(CH 3) 2 –CH(CH 3) – CH 2 –CH 3 هناك ذرة كربون رباعية واحدة، وذرة ثالثية واحدة، وذرة كربون ثانوية واحدة وخمس ذرات كربون أولية. تؤثر البيئات المختلفة لذرات الكربون بشكل كبير على تفاعل ذرات الهيدروجين المرتبطة بها.
يؤدي الترتيب المكاني للمدارات sp 3، بدءًا من البروبان، إلى تكوين متعرج لسلاسل الكربون. في هذه الحالة، يكون دوران الأجزاء الجزيئية حول روابط C-C ممكنًا (في جزيء الإيثان عند درجة حرارة 20 درجة مئوية - بسرعة ملايين الدورات في الثانية!)، مما يجعل جزيئات الألكانات الأعلى مرنة. يحدث استقامة مثل هذه السلاسل، على سبيل المثال، عند مد البولي إيثيلين، الذي يتكون من خليط من الألكانات ذات سلاسل طويلة، وتتفاعل جزيئات الألكان مع بعضها البعض بشكل ضعيف، لذلك تذوب الألكانات وتغلي عند درجات حرارة أقل بكثير من المواد المماثلة ذات الجزيئات القطبية. أول 4 أعضاء من سلسلة الميثان المتماثلة هي غازات في الظروف العادية، ويمكن تسييل البروبان والبيوتان بسهولة تحت ضغط منخفض (يوجد خليط البروبان والبيوتان السائل في أسطوانات الغاز المنزلية). المتجانسات الأعلى هي سوائل برائحة البنزين أو مواد صلبة غير قابلة للذوبان في الماء وتطفو على سطحها. تزداد درجات انصهار وغليان الألكانات مع زيادة عدد ذرات الكربون في الجزيء، بينما تتباطأ زيادة درجة الحرارة تدريجياً، على سبيل المثال، C 100 H 202 يذوب عند 115 درجة مئوية، C 150 H 302 - عند 123 درجة مئوية. وترد في الجدول نقاط غليان الألكانات الـ 25 الأولى - ومن الواضح أنه بدءًا من الأوكتاديكان، تكون الألكانات مواد صلبة.
| طاولة. درجات حرارة انصهار وغليان الألكانات | ||
| ألكان | ترر | تبالة |
| الميثان | –182,5 | –161,5 |
| الإيثان | –183,3 | –88,6 |
| البروبان | –187,7 | –42,1 |
| البيوتان | –138,4 | –0,5 |
| البنتان | –129,7 | 36,1 |
| الهكسان | –95,3 | 68,7 |
| هيبتان | –90,6 | 98,4 |
| أوكتان | –56,8 | 125,7 |
| نونان | –51,0 | 150,8 |
| عميد | –29,7 | 174,1 |
| اندكان | –25,6 | 195,9 |
| دوديكان | –9,6 | 216,3 |
| تريديكان | –5,5 | 235,4 |
| تيتراديكان | +5,9 | 253,7 |
| بنتاديكان | +9,9 | 270,6 |
| هيكساديكان | 18,2 | 286,8 |
| هيبتاديكان | 22,0 | 301,9 |
| أوكتاديكان | 28,2 | 316,1 |
| نوناديكان | 32,1 | 329,7 |
| إيكوسان | 36,8 | 342,7 |
| جينيكوزان | 40,5 | 356,5 |
| دوكوزان | 44,4 | 368,6 |
| تريكوزان | 47,6 | 378,3 |
| تيتراكوسان | 50,9 | 389,2 |
| بنتاكوسان | 53,7 | 399,7 |
إن وجود فرع في السلسلة يغير الخصائص الفيزيائية بشكل كبير، وخاصة نقطة الانصهار. لذا، إذا كان للهكسان بنية طبيعية ( ن-الهكسان) عند -95.3 درجة مئوية، ثم ينصهر إيزوميريه 2-ميثيل بنتان عند -153.7 درجة مئوية. ويرجع ذلك إلى صعوبة تعبئة الجزيئات المتفرعة أثناء تبلورها. ونتيجة لذلك، فإن الألكانات ذات الفروع المتسلسلة لا تتبلور عند التبريد السريع، ولكنها تتحول إلى الحالة الزجاجية لسائل فائق التبريد ( سم. زجاج). على سبيل المثال، إذا تم غمر أمبولة رقيقة من البنتان في النيتروجين السائل (درجة الحرارة -196 درجة مئوية)، فسوف تتحول المادة إلى كتلة بيضاء تشبه الثلج، بينما يتصلب الأيزوبنتان (2-ميثيل بيوتان) إلى "زجاج" شفاف.
تعتمد الطريقة الأصلية لفصلها على الاختلاف في الشكل الهندسي للألكانات الخطية والمتفرعة: تحتوي بلورات اليوريا على قنوات يمكن أن تتناسب فيها الألكانات ذات السلسلة المستقيمة، لكن لا يمكن للألكانات المتفرعة ذلك.
الألكانات الحلقية مع ن= 2، 3 – الغازات، الأعلى – السوائل أو المواد الصلبة. أكبر دورة تمكن الكيميائيون من تصنيعها هي cyclooctaoctacontadictane C 288 H 576. تؤدي الأشكال المختلفة لجزيئات الألكان الحلقي ذات الأعداد الزوجية والفردية لذرات الكربون في الجزيء إلى تأثير زوجي وفرد قوي فيما يتعلق بنقطة الانصهار، كما يتبين من الجدول. يتم تفسير هذا التأثير من خلال الاختلاف في "ملاءمة" تعبئة الجزيئات ذات الأشكال المختلفة في البلورة: فكلما كانت التعبئة أكثر إحكاما، كانت البلورة أقوى وارتفعت نقطة انصهارها. على سبيل المثال، يذوب الدوديكان الحلقي بدرجة أعلى بمقدار 70 درجة تقريبًا من أقرب مثيل له، وهو السيكلونديكان. وبطبيعة الحال، فإن كتلة الجزيء مهمة أيضًا: إذ تذوب جزيئات الضوء عند درجة حرارة أقل.
| ج3ح6 | –127,5 |
| ج4ح8 | –50 |
| ج5ح10 | –93,9 |
| ج6ح12 | +6,5 |
| ج7ح14 | –12 |
| ج8ح16 | 14,3 |
| س9ح18 | 9,7 |
| ج10ن20 | 10,8 |
| ج11ن22 | –7,2 |
| ج12 ح24 | 61,6 |
| ج13ن26 | 23,5 |
| ج14ن28 | 54 |
| ج15ن30 | 62,1 |
تؤدي سهولة الدوران حول الرابطة C-C إلى حقيقة أن جزيئات الألكانات الحلقية ليست مستوية (باستثناء البروبان الحلقي)، وبهذه الطريقة تتجنب التشوه القوي لزوايا الرابطة. وهكذا، في الهكسان الحلقي ومتجانساته الأعلى تكون زوايا الرابطة مسترخية وقريبة من رباعي السطوح (109 درجة)، بينما في الشكل السداسي تكون الزوايا 120 درجة، وفي المثمن - 135 درجة، وما إلى ذلك. لا تشغل ذرات الكربون الفردية في مثل هذه الألكانات الحلقية موقعًا ثابتًا بشكل صارم: فالحلقة تبدو وكأنها في حركة موجية ثابتة. وبالتالي، يمكن أن يكون جزيء الهكسان الحلقي على شكل هياكل هندسية مختلفة (مطابقات) يمكن أن تتحول إلى بعضها البعض (انعكاس الدورة). نظرًا لتشابههما الخارجي ، فقد أطلق عليهما اسم "حوض الاستحمام" و "الكرسي" (في الأدب الإنجليزي يُطلق على "حوض الاستحمام" اسم "القارب"):
شكل الكرسي أكثر استقرارًا؛ في درجات الحرارة العادية، يوجد 99.9% من الهكسان الحلقي في شكل الكرسي الأكثر استقرارًا. يحدث الانتقال بين شكلين من خلال "تشكيل ملتوي" وسيط (من الإنجليزية. إلتواء- إلتواء).
في البروبان الحلقي، تنخفض الزاوية من 108° إلى 60°، مما يؤدي إلى توتر عالي وروابط "منحنية" تكون وسيطة بين روابط s وp العادية؛ ونظرًا لشكلها، تسمى هذه الروابط بسندات "الموز". في هذه الحالة، تتداخل مدارات sp 3 لذرات الكربون جزئيًا فقط. والنتيجة هي ازدواجية في الخواص الكيميائية للسيكلوبروبان. من ناحية، من الممكن استبدال ذرات الهيدروجين فيه (تفاعل نموذجي للألكانات)، من ناحية أخرى، من الممكن إضافة مع فتح الحلقة (تفاعل نموذجي للألكينات، على سبيل المثال: سيكلو-C3H6 + Br2®BrCH2CH2CH2Br).
تسمى الألكانات الحلقية ذات الحلقتين وذرة الكربون المشتركة بالألكانات الحلزونية. إذا كان هناك أكثر من ذرتين كربون مشتركتين، فسيتم تشكيل ألكانات ثنائية الحلقية، وألكانات ثلاثية الحلقات، وما إلى ذلك. ونتيجة لهذا "الربط المتقاطع" لعدة دورات في وقت واحد، تمكن الكيميائيون من الحصول على الهيدروكربونات، التي يتوافق تركيبها المكاني مع مختلف متعددات السطوح: رباعي السطوح، مكعب، منشور، إلخ. توجد مشتقات الهكسان الحلقي ثنائية الحلقات في الزيوت العطرية والراتنجات الصنوبرية وزيت التربنتين. توجد دورة مكونة من ست وخمس ذرات كربون في الكافور والكوليسترول والسكارين والبيبرين (وهو ما يعطي الطعم الحار للفلفل الأسود) والقواعد النيتروجينية - النيوكليوتيدات ومركبات أخرى (يمكن ربط بعض ذرات الكربون في الدورات بروابط مزدوجة). ، ويتم استبدال بعضها بذرات أخرى، كما هو الحال في السكرين). توجد دورة مكونة من 17 ذرة كربون (اثنتان منها مرتبطتان برابطة مزدوجة) في الزباد، وهي مادة ذات رائحة، أحد مكونات المسك، والتي تستخدم في صناعة العطور. يحتوي جزيء الأدمانتان الجميل على ثلاث حلقات سداسية الأعضاء وبنيتها تتوافق مع الشبكة البلورية للماس. تم العثور على بنية الأدمانتان في عقار الريمانتادين المضاد للفيروسات، في هيكساميثيلين تيترامين (في المركب الأخير، يتم استبدال 4 ذرات كربون بذرات النيتروجين، التي ترتبط ببعضها البعض بواسطة جسور الميثيلين – CH 2 –). فيما يلي هياكل بعض الألكانات الحلقية، التي تحتوي جزيئاتها على أكثر من حلقة متصلة بشكل مختلف.
ثنائي سيكلوديكان (رباعي هيدرونفثالين، ديكالين)
أدامانتان
الخواص الكيميائية للألكانات.
الألكانات هي المركبات العضوية الأقل نشاطًا كيميائيًا. جميع روابط C–C وC–H في الألكانات أحادية، لذا فإن الألكانات غير قادرة على تفاعلات الإضافة. تتميز الألكانات بتفاعلات استبدال ذرات الهيدروجين بذرات ومجموعات ذرات أخرى. وبالتالي، عندما يتم كلورة الميثان، يتم تشكيل كلوريد الميثيل CH 3 Cl، وكلوريد الميثيلين CH 2 Cl 2، وثلاثي كلورو الميثان (كلوروفورم) CHCl 3، ورابع كلوريد الكربون (رابع كلوريد الكربون) CCl 4. تتبع هذه التفاعلات آلية متسلسلة مع تكوين متوسط للجذور الحرة.
عند كلورة الألكانات، بدءًا من البروبان، يمكن لذرة الكلور الأولى أن تحل محل ذرات الهيدروجين المختلفة. يعتمد اتجاه الاستبدال على قوة الرابطة C-H: فكلما كانت أضعف، كلما كان استبدال هذه الذرة المحددة أسرع. عادة ما تكون روابط C-H الأولية أقوى من الروابط الثانوية، والثانوية أقوى من الروابط الثالثة. ونتيجة لذلك، فإن الكلورة عند 25 درجة مئوية على طول الرابطة الثانوية (CH 3) 2 CH – H تحدث أسرع بـ 4.5 مرة من خلال الرابطة الأولية C 2 H 5 –H، والرابطة الثالثة (CH 3) 3 C – H – بمعدل 6.7 مرات أسرع. يمكن أن يؤدي التفاعل المختلف لذرات الهيدروجين الأولية والثانوية والثالثية إلى هيمنة منتج واحد فقط من بين العديد من منتجات الكلورة المحتملة. على سبيل المثال، عندما تتم كلورة 2،3-ثنائي ميثيل البيوتان في محلول ثاني كبريتيد الكربون (CS 2)، يتم تكوين 95% من مشتق 2-كلورو و5% فقط من مشتق 1-كلورو، أي. 19 مرة أقل. إذا أخذنا في الاعتبار أنه يوجد في الألكان الأصلي ذرات هيدروجين أولية أكثر بـ 6 مرات من ذرات الهيدروجين الثالث، فإن نسبة تفاعلها ستكون أكبر (19 ч 6 = 114). ثاني كبريتيد الكربون كمذيب يقلل من تفاعل ذرات الكلور وبالتالي يزيد من انتقائيتها. يعمل خفض درجة الحرارة بنفس الطريقة.
ذرات البروم أقل نشاطا؛ تؤدي طاقة التنشيط الملحوظة لهذا التفاعل إلى حقيقة أن معالجة الألكانات بالبروم، على الرغم من حدوثها بواسطة آلية سلسلة، تكون أبطأ بكثير من الكلورة، وفقط في درجات حرارة مرتفعة أو في الضوء. يؤدي انخفاض نشاط ذرات البروم أيضًا إلى زيادة انتقائية البرومة. وبالتالي، إذا كان المعدل النسبي للبرومة الكيميائية الضوئية للإيثان عند 40 درجة مئوية يساوي 1، فإن معدل المعالجة بالبروم للبروبان (عند ذرة H الثانوية) سيكون بالفعل 220 في ظل نفس الظروف، ومعدل المعالجة بالبروم للبروبان (عند ذرة H الثانوية) سيكون بالفعل 220 في نفس الظروف، ومعدل المعالجة بالبروم للبروبان سيكون الأيزوبيوتان (في ذرة H الثالثة) 19000
ذرات اليود هي الأقل نشاطًا، وبالتالي فإن تفاعل إضافة اليود إلى الألكانات RH + I 2 ® RI + HI هو تفاعل ماص للحرارة، وهو ممكن فقط عند درجات حرارة عالية ويحدث بسلاسل قصيرة جدًا. علاوة على ذلك، فإن التفاعل الطارد للحرارة العكسي RI + HI ® RH + I 2 يحدث بسهولة شديدة. عند معالجة الألكانات باليود، تتشكل أيضًا مركبات غير مشبعة. على سبيل المثال، عند 685 درجة مئوية، يتفاعل الإيثان مع اليود، ويشكل 72% إيثيلين و10% أسيتيلين. تم الحصول على نفس النتائج مع البروبان والبيوتان والبنتان.
يستمر تفاعل الفلورة للألكانات بمعدل مرتفع جدًا، وغالبًا ما يكون متفجرًا، مع تكوين جميع المشتقات المتعددة الفلور الممكنة للألكان الأصلي. إن الطاقة المنطلقة أثناء فلورة الألكانات كبيرة جدًا لدرجة أنها يمكن أن تؤدي إلى تحلل جزيئات المنتج إلى جذور تبدأ سلاسل جديدة. ونتيجة لذلك، يزداد معدل التفاعل مثل الانهيار الجليدي، مما يؤدي إلى انفجار حتى في درجات الحرارة المنخفضة. خصوصية فلورة الألكانات هي إمكانية تدمير الهيكل الكربوني بواسطة ذرات الفلور مع تكوين CF 4 كمنتج نهائي مع الهالوجينات الأخرى، ولا يحدث مثل هذا التفاعل.
تتبع نترتة الألكانات (تفاعل كونوفالوف) أيضًا آلية جذرية: RH + NO 2 ® R· + HNO 2, R· + NO 2 ® RNO 2. مصدر NO 2 هو حمض النيتريك، الذي يتحلل عند تسخينه. يتم إجراء التفاعل في محلول عند درجات حرارة أعلى من 150 درجة مئوية أو في بخار تحت ضغط يصل إلى 10 ضغط جوي ودرجة حرارة 400 - 500 درجة مئوية. وفي الحالة الأخيرة، يتم أيضًا كسر روابط C-C في الألكانات وخليط من يتم تشكيل النيتروألكانات.
تحترق جميع الألكانات بإطلاق الحرارة، على سبيل المثال: C 5 H 12 + 8O 2 ® 5CO 2 + 6 H 2 O. ويحدث هذا التفاعل، على وجه الخصوص، في أسطوانات محركات الاحتراق الداخلي. لمنع دخول بقايا الألكانات غير المحترقة إلى الغلاف الجوي، يتم استخدام حرقها الحفزي في أنابيب العادم (في الوقت نفسه، يتم حرق ثاني أكسيد الكربون وتحويل أكاسيد النيتروجين إلى نيتروجين غير ضار). يحدث تفاعل الأكسجين مع الألكانات الأعلى (في البارافين) عندما تحترق الشمعة. تشكل الألكانات الغازية، مثل الميثان، مخاليط متفجرة مع الهواء. يمكن أن تتشكل مثل هذه المخاليط في المناجم وكذلك في المباني السكنية بسبب تسرب الغاز المنزلي إذا وصل محتواه في الهواء إلى 5٪.
تهدف الجهود الكبيرة التي بذلها الكيميائيون إلى إجراء دراسة تفصيلية لتفاعل أكسدة الألكانات في درجات الحرارة المنخفضة من أجل إيقافها في مرحلة تكوين المنتجات الوسيطة القيمة - الألدهيدات والكيتونات والكحوليات والأحماض الكربوكسيلية. وهكذا، في وجود أملاح Co(II) وMn(II)، يمكن أكسدة البيوتان إلى حمض أسيتيك، والبارافين إلى أحماض دهنية C12-C18. تنتج أكسدة الهكسان الحلقي الكابرولاكتام، وهو مونومر لإنتاج الكابرون، وحمض الأديبيك.
أحد التفاعلات الصناعية المهمة هو الكلورة الكبريتية الكيميائية الضوئية للألكانات: تفاعل متسلسل جذري مشترك مع Cl 2 وSO 2 مع تكوين كلوريدات حمض الألكان سلفونيك RSO 2 Cl. يستخدم هذا التفاعل على نطاق واسع في إنتاج المنظفات. عند استبدال الكلور بالأكسجين، يحدث تفاعل جذري متسلسل للأكسدة السلفونية للألكانات مع تكوين أحماض الألكان سلفونيك R-SO 2 –OH. وتستخدم أملاح الصوديوم لهذه الأحماض كمنظفات وعوامل استحلاب.
عند درجات الحرارة المرتفعة، يحدث التحلل (التحلل الحراري) للألكانات، على سبيل المثال: CH 4 ® C + 2H 2 (1000° C)، 2CH 4 ® C 2 H 2 + 3H 2 (1500 درجة مئوية)، C 2 H 6 ® C 2 ح 4 + ح2. ويحدث التفاعل الأخير عند درجة حرارة 500 درجة مئوية في وجود عامل حفاز (Ni). وبالمثل، يمكن الحصول على 2-بوتين CH 3 CH = CHCH 3 من البيوتان، وفي نفس الوقت يتم تكوين خليط من الإيثيلين والإيثان. وعلى النقيض من هذا التفاعل الجذري، فإن التكسير الحفزي للألكانات يستمر من خلال آلية أيونية ويعمل على إنتاج البنزين من الأجزاء البترولية الأثقل. عند تسخينها في وجود أحماض لويس، على سبيل المثال، AlCl 3، تحدث الأيزومرة: يتم تحويل الألكانات غير المتفرعة (العادية) إلى ألكانات متفرعة بنفس عدد ذرات الكربون. هذا التفاعل له أهمية عملية كبيرة للحصول على وقود محرك عالي الجودة ( سم. رقم الأوكتان). يمكن أن يصاحب نزع الهيدروجين من الألكانات إغلاق الحلقة (إزالة التحلل المائي). في حالة نزع هيدروكلوريد الهكسان، المنتج الرئيسي هو البنزين.
يتفاعل الميثان عند درجة حرارة عالية في وجود محفز مع بخار الماء وأول أكسيد الكربون (IV) لتكوين غاز التخليق: CH 4 + H 2 O ® CO + 3H 2، CH 4 + CO 2 ® 2CO + 2H 2. يستخدم الغاز الاصطناعي لإنتاج وقود السيارات وكحول الميثيل.
في السنوات الأخيرة، كانت جهود الكيميائيين تهدف إلى إنشاء محفزات تعمل على تنشيط روابط C-H في جزيئات الألكان في ظل ظروف معتدلة. بعض الكائنات الحية الدقيقة "يمكنها" تنفيذ مثل هذه التفاعلات، حيث تكون إنزيماتها قادرة على "هضم" حتى البارافين مع تكوين مركبات البروتين. مهمة الكيميائيين هي فهم كيفية عمل المحفزات الطبيعية ونمذجة التفاعلات الأنزيمية التي يمكن أن تحدث في درجات الحرارة العادية. في هذه الحالة، يتم استخدام المركبات المعدنية العضوية المختلفة كمحفزات. على سبيل المثال، في وجود بعض مركبات البلاتين، يمكن الحصول على الميثانول CH 3 OH مباشرة من الميثان، وفي وجود مركب ثلاثي فينيل فوسفين من الروديوم Rh[(C 6 H 5) 3 P] المرتبط بجزيئات ثاني أكسيد الكربون؛ أثناء التفاعل، يتم إدخال جزيئات ثاني أكسيد الكربون في روابط C-H للألكانات لتكوين الألدهيدات.
الألكانات الحلقية لها خواص كيميائية مشابهة للألكانات. وبالتالي، فهي قابلة للاشتعال، ويمكن أن تكون مهلجنة بواسطة آلية جذرية، وفي درجات حرارة مرتفعة في وجود محفزات يتم نزع الهيدروجين منها - فهي تفصل الهيدروجين وتتحول إلى هيدروكربونات غير مشبعة. كما ذكرنا سابقًا، فإن البروبان الحلقي له خصائص خاصة. على عكس الألكانات، تتم هدرجة الألكانات الحلقية، عندما تنفتح الحلقة وتتكون الألكانات، على سبيل المثال: سيكلو-C 3 H 6 + H 2 ® C 3 H 8 (يحدث التفاعل عند تسخينه في وجود محفز البلاتين). مع زيادة حجم الدورة، يصبح التفاعل أكثر صعوبة - وبالتالي، يتم هدرجة السيكلوبنتان بالفعل (إلى البنتان) بصعوبة كبيرة وفي درجات حرارة عالية (300 درجة مئوية).
التواجد في الطبيعة والتلقي.
المصادر الرئيسية للألكانات هي النفط والغاز الطبيعي. ويشكل الميثان الجزء الأكبر من الغاز الطبيعي، ويحتوي أيضًا على كميات صغيرة من الإيثان والبروبان والبيوتان. ويوجد الميثان في الانبعاثات الصادرة عن المستنقعات وطبقات الفحم. جنبا إلى جنب مع المتجانسات الخفيفة، يوجد الميثان في الغازات البترولية المصاحبة. تذوب هذه الغازات في الزيت تحت الضغط وتوجد فوقه أيضًا. تشكل الألكانات جزءًا كبيرًا من المنتجات البترولية. يحتوي الزيت أيضًا على ألكانات حلقية - تسمى النفثينات (من الكلمة اليونانية. النفتا- زيت). هيدرات غاز الألكانات، وخاصة الميثان، منتشرة على نطاق واسع في الطبيعة، وتوجد في الصخور الرسوبية في القارات وفي قاع المحيطات. من المحتمل أن تتجاوز احتياطياتها الاحتياطيات المعروفة من الغاز الطبيعي وقد تصبح في المستقبل مصدرًا لغاز الميثان وأقرب متجانساته.
يتم الحصول على الألكانات أيضًا عن طريق الانحلال الحراري (فحم الكوك) للفحم وهدرجته (إنتاج الوقود السائل الاصطناعي). توجد الألكانات الصلبة في الطبيعة على شكل رواسب من الشمع الجبلي - أوزوكريت، في الطبقات الشمعية للأوراق والزهور وبذور النباتات، وهي جزء من شمع العسل.
في الصناعة، يتم إنتاج الألكانات عن طريق الهدرجة الحفزية لأكاسيد الكربون CO وCO 2 (طريقة فيشر تروبش). في المختبر، يمكن الحصول على الميثان عن طريق تسخين أسيتات الصوديوم مع مادة قلوية صلبة: CH 3 COONa + NaOH ® CH 4 + Na 2 CO 3 ، وكذلك عن طريق التحلل المائي لبعض الكربيدات: Al 4 C 3 + 12H 2 O ® 3CH 4 + 4Al(OH) 3 . يمكن الحصول على متجانسات الميثان عن طريق تفاعل فورتز، على سبيل المثال: 2CH 3 Br + 2Na ® CH 3 –CH 3 + 2NaBr. في حالة الألكانات الثنائية، يتم الحصول على الألكانات الحلقية، على سبيل المثال: Br–CH 2 –(CH 2) 4 –CH 2 Br + 2Na ® سيكلو-C6H12+2NaBr. تتشكل الألكانات أيضًا أثناء نزع الكربوكسيل من الأحماض الكربوكسيلية وأثناء تحليلها الكهربائي.
تطبيق الألكانات.
تُستخدم الألكانات الموجودة في البنزين والكيروسين وزيت الديزل وزيت الوقود كوقود. توجد الألكانات الأعلى في زيوت التشحيم والفازلين والبارافين. يُطلق على خليط من البنتانات والهكسان الأيزوميرية اسم الأثير البترولي ويستخدم كمذيب. يستخدم الهكسان الحلقي أيضًا على نطاق واسع كمذيب ولتخليق البوليمرات (النايلون والنايلون). يستخدم السيكلوبروبان للتخدير. السكوالان هو زيت تشحيم عالي الجودة، وهو أحد مكونات المستحضرات الصيدلانية والتجميلية، وممتص في كروماتوغرافيا الغاز والسائل.
تعمل الألكانات كمواد خام لإنتاج العديد من المركبات العضوية، بما في ذلك الكحولات والألدهيدات والأحماض. تستخدم مشتقات الكلور من الألكانات كمذيبات، على سبيل المثال، ثلاثي كلورو الميثان (الكلوروفورم) CHCl 3، رابع كلوريد الكربون CCl 4. خليط من الألكانات الأعلى - البارافين غير سام ويستخدم على نطاق واسع في صناعة المواد الغذائية لتشريب الحاويات ومواد التعبئة والتغليف (على سبيل المثال، علب الحليب)، وفي إنتاج العلكة. يتم تشريب أقلام الرصاص والجزء العلوي (بالقرب من الرأس) من أعواد الثقاب بالبارافين لتحسين الاحتراق. يستخدم البارافين المسخن للأغراض الطبية (علاج البارافين). تؤدي أكسدة البارافين تحت ظروف خاضعة للرقابة وبوجود محفزات (أملاح معدنية انتقالية عضوية) إلى إنتاج منتجات تحتوي على الأكسجين، وخاصة الأحماض العضوية.
ايليا لينسون
الأدب:
بيتروف أ.أ. كيمياء الألكانات. م.، ناوكا، 1974
أذربيجان آي.إن. وإلخ. التوليفات القائمة على الهيدروكربونات البترولية. ألما آتا، العلوم، 1974
روداكوف إي إس. تفاعلات الألكانات مع العوامل المؤكسدة والمجمعات المعدنية والجذور في المحاليل. كييف، ناوكوفا دومكا، 1985
باراوشانو ف. إنتاج واستخدام الهيدروكربونات. م. الكيمياء، 1987