آلکان ها به طور خلاصه آلکان ها: خواص شیمیایی
خواص فیزیکی آلکان ها
در شرایط عادی، چهار عضو اول سری همولوگ آلکان ها (C1 - C4) گاز هستند. آلکان های معمولی از پنتان تا هپتادکان (C 5 - C 17) مایع هستند و از C 18 به بالا جامد هستند. با افزایش تعداد اتم های کربن در زنجیره، به عنوان مثال. با افزایش وزن مولکولی نسبی، نقطه جوش و ذوب آلکان ها افزایش می یابد.
با تعداد اتم های کربن یکسان در مولکول، آلکان های شاخه دار نقطه جوش کمتری نسبت به آلکان های معمولی دارند.
آلکان ها عملا در آب نامحلول هستند، زیرا مولکول های آنها کم قطب هستند و با مولکول های آب برهمکنش ندارند. آلکان های مایع به راحتی با یکدیگر مخلوط می شوند. آنها به خوبی در حلال های آلی غیر قطبی مانند بنزن، تتراکلرید کربن و غیره حل می شوند.
ساختار
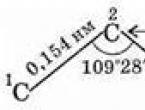
مولکول ساده ترین آلکان - متان - به شکل یک چهار وجهی منظم است که در مرکز آن یک اتم کربن و در راس آن اتم های هیدروژن وجود دارد. زاویه بین محورهای پیوندهای C-H 109 درجه 28 اینچ است (شکل 29).
در مولکول های دیگر هیدروکربن های اشباع، زوایای بین پیوندها (هر دو C-H و C-C) به یک معنا هستند. برای توصیف شکل مولکول ها استفاده می شود مفهوم هیبریداسیون اوربیتال های اتمی(بخش اول، §6 را ببینید).
در آلکان ها، تمام اتم های کربن در حالت هستند sp 3 -هیبریداسیون (شکل 30).
بنابراین، اتم های کربن در زنجیره کربن در یک خط مستقیم نیستند. فاصله بین اتم های کربن همسایه (بین هسته اتم ها) کاملاً ثابت است - این طول پیوند شیمیایی(0.154 نانومتر). فاصله C 1 - C 3، C 2 - C 4 و غیره (از طریق یک اتم) نیز ثابت هستند، زیرا زاویه بین پیوندها ثابت است - زاویه پیوند

فاصله بین اتمهای کربن دورتر میتواند در نتیجه چرخش حول پیوندهای s تغییر کند (در محدودههای معین). این چرخش همپوشانی اوربیتال هایی را که پیوند s را تشکیل می دهند، مختل نمی کند، زیرا این پیوند دارای تقارن محوری است.


اشکال فضایی مختلف یک مولکول که از چرخش گروههایی از اتمها به دور پیوندهای s تشکیل میشوند نامیده میشوند. رونوشت ها(شکل 31).
ترکیبات از نظر انرژی متفاوت است، اما این تفاوت کم است (12-15 کیلوژول بر مول). ترکیب آلکان ها که در آن اتم ها تا حد امکان از هم فاصله دارند، پایدارتر هستند (دفع لایه های الکترونی). انتقال از یک ترکیب به ترکیب دیگر به دلیل انرژی حرکت حرارتی انجام می شود. برای به تصویر کشیدن ترکیب، از فرمول های فضایی ویژه (فرمول های نیومن) استفاده می شود.
گیج نشو!
لازم است بین مفاهیم ترکیب و پیکربندی تمایز قائل شد.
ترکیبات مختلف می توانند بدون شکستن پیوندهای شیمیایی به یکدیگر تبدیل شوند. برای تبدیل یک مولکول با یک پیکربندی به یک مولکول با پیکربندی دیگر نیاز به شکستن پیوندهای شیمیایی است.
از چهار نوع ایزومریسمآلکان ها با دو مشخصه مشخص می شوند: ایزومری اسکلت کربن و ایزومری نوری (بخش را ببینید
پیوندهای شیمیایی در آلکان ها، شکستن و تشکیل آنها، تعیین کننده خواص شیمیایی آلکان ها است. پیوندهای C-C و C-H کووالانسی، ساده (s-پیوندها)، عملاً غیر قطبی، کاملاً قوی هستند، بنابراین:
1) آلکان ها اغلب وارد واکنش هایی می شوند که شامل شکست همولیتیک پیوندها می شود.
2) در مقایسه با ترکیبات آلی کلاس های دیگر، آلکان ها واکنش پذیری پایینی دارند (به همین دلیل به آنها می گویند. پارافین ها- "عاری از خاصیت"). بنابراین، آلکان ها در برابر عمل محلول های آبی اسیدها، قلیایی ها و عوامل اکسید کننده (به عنوان مثال، پرمنگنات پتاسیم) حتی در زمان جوشاندن مقاوم هستند.
آلکان ها با افزودن مولکول های دیگر به آنها واکنش نشان نمی دهند، زیرا آلکان ها در مولکول های خود پیوندهای متعددی ندارند.
آلکان ها تحت حرارت قوی در حضور کاتالیزورهایی به شکل پلاتین یا نیکل تجزیه می شوند و هیدروژن از آلکان ها حذف می شود.
آلکان ها می توانند تحت واکنش های ایزومریزاسیون قرار گیرند. واکنش معمولی آنها این است واکنش جایگزینی،از طریق یک مکانیسم رادیکال پیش می رود.
خواص شیمیایی
واکنش های جابجایی رادیکال
به عنوان مثال در نظر بگیرید برهمکنش آلکان ها با هالوژن هافلوئور بسیار شدید واکنش می دهد (معمولاً با انفجار) - در این حالت، تمام پیوندهای C-H و C-C شکسته می شوند و در نتیجه ترکیبات CF 4 و HF تشکیل می شوند. واکنش هیچ اهمیت عملی ندارد. ید با آلکان ها تعامل ندارد. واکنش با کلر یا برم یا با نور یا با گرمای قوی رخ می دهد. در این مورد، تشکیل آلکان های جایگزین تک تا چند هالوژن رخ می دهد، به عنوان مثال:
CH 3 -CH 3 +Cl 2 ® hv CH 3 -CH 2 -Cl+HCl
تشکیل مشتقات هالوژن متان از طریق یک زنجیره انجام می شود رادیکال آزادسازوکار. تحت تأثیر نور، مولکول های کلر به رادیکال های معدنی تجزیه می شوند:
رادیکال غیر آلی Cl. اتم هیدروژن را با یک الکترون از مولکول متان انتزاع می کند و HC1 و رادیکال آزاد CH3 را تشکیل می دهد.
![]()
رادیکال آزاد با مولکول کلر Cl 2 تعامل می کند و یک مشتق هالوژن و یک رادیکال کلر را تشکیل می دهد.
![]()
واکنش اکسیداسیون با انتزاع یک اتم هیدروژن توسط یک مولکول اکسیژن (که یک دیرادیکال است) آغاز می شود و سپس به صورت یک واکنش زنجیره ای منشعب ادامه می یابد. تعداد رادیکال ها در طول واکنش افزایش می یابد. روند همراه است
با آزاد شدن مقدار زیادی گرما، نه تنها پیوندهای C-H، بلکه پیوندهای C-C نیز شکسته می شوند، به طوری که در نتیجه مونوکسید کربن (IV) و آب تشکیل می شود. واکنش ممکن است به صورت احتراق و یا منجر به انفجار انجام شود.
2С n Н2 n+2 +(3n+1)О 2 ®2nСО 2 +(2n+2)Н 2 O
در دماهای معمولی، واکنش اکسیداسیون رخ نمی دهد. می توان آن را یا با احتراق یا با تخلیه الکتریکی شروع کرد.
با حرارت قوی (بیش از 1000 درجه سانتیگراد)، آلکانها به طور کامل به کربن و هیدروژن تجزیه می شوند. این واکنش نامیده می شود پیرولیز
CH 4 ® 1200 ° C + 2H 2
با اکسیداسیون ملایم آلکان ها، به ویژه متان، با اکسیژن اتمسفر در حضور کاتالیزورهای مختلف، می توان متیل الکل، فرمالدئید و اسید فرمیک به دست آورد.

اگر متان خیلی سریع از یک منطقه گرم عبور داده شود و بلافاصله با آب سرد شود، نتیجه استیلن است.
این واکنش اساس یک سنتز صنعتی است به نام ترک خوردن(تجزیه ناقص) متان.
ترک خوردگی همولوگ های متان در دمای پایین تر (حدود 600 درجه سانتی گراد) انجام می شود. به عنوان مثال، ترک پروپان شامل مراحل زیر است:

بنابراین، ترک خوردگی آلکان ها منجر به تشکیل مخلوطی از آلکان ها و آلکن های با وزن مولکولی کمتر می شود.
حرارت دادن آلکان ها به دمای 300-350 درجه سانتی گراد (هنوز ترک خوردگی رخ نداده است) در حضور کاتالیزور (Pt یا Ni) منجر به هیدروژن زدایی- حذف هیدروژن

هنگامی که اسید نیتریک رقیق در دمای 140 درجه سانتیگراد و فشار کم روی آلکانها اثر می کند، یک واکنش رادیکال رخ می دهد:
CH 3 -CH 3 + HNO 3 ®CH 3 -CH 2 -NO 2 + H 2 O ایزومریزاسیون
تحت شرایط خاص، آلکان های معمولی می توانند به آلکان های با زنجیره شاخه تبدیل شوند.
تهیه آلکان ها
بیایید تولید آلکان ها را با استفاده از مثال تولید متان در نظر بگیریم. متان در طبیعت گسترده است. این جزء اصلی بسیاری از گازهای قابل اشتعال، چه طبیعی (90-98٪) و چه مصنوعی است که در هنگام تقطیر خشک چوب، ذغال سنگ نارس، زغال سنگ و همچنین در هنگام ترک خوردگی نفت آزاد می شود. گازهای طبیعی، به ویژه گازهای مرتبط از میادین نفتی، علاوه بر متان، حاوی اتان، پروپان، بوتان و پنتان هستند.
متان از کف باتلاق ها و از درزهای زغال سنگ در معادن آزاد می شود، جایی که در طی تجزیه آهسته بقایای گیاهی بدون دسترسی به هوا تشکیل می شود. بنابراین، متان را اغلب گاز باتلاقی یا آتشگیر می نامند.
در آزمایشگاه، متان با حرارت دادن مخلوطی از استات سدیم و هیدروکسید سدیم تولید می شود:
CH 3 COONa + NaOH® 200 ° Na 2 CO 3 + CH 4
یا زمانی که کاربید آلومینیوم با آب برهمکنش می کند: Al 4 Cl 3 + 12H 2 O® 4Al (OH) 3 + 3CH 4
در مورد دوم، متان بسیار خالص است.
متان را می توان از مواد ساده با حرارت دادن در حضور کاتالیزور تولید کرد:
C+2H 2 ® Ni CH 4 8 نیز با سنتز بر اساس گاز آب
CO+3H 2 ® Ni CH 4 + H 2 O
این روش از اهمیت صنعتی برخوردار است. با این حال، متان از گازهای طبیعی یا گازهای تشکیل شده در طی کک شدن زغال سنگ و در طی پالایش نفت معمولاً استفاده می شود.
همولوگ های متان، مانند متان، در شرایط آزمایشگاهی از طریق تکلیس نمک های اسیدهای آلی مربوطه با قلیاها به دست می آیند. روش دیگر واکنش Wurtz است، یعنی. حرارت دادن مشتقات مونو هالوژن با فلز سدیم، به عنوان مثال:
C 2 H 5 Br + 2 Na + BrC 2 H 6 ® C 2 H 5 - C 2 H 5 + 2 NaBr
در فناوری، سنتز برای تولید بنزین فنی (مخلوطی از هیدروکربن های حاوی 6-10 اتم کربن) استفاده می شود.
از مونوکسید کربن (II) و هیدروژن در حضور یک کاتالیزور (ترکیب کبالت) و در فشار بالا. روند
را می توان با معادله بیان کرد
nСО+(2n+1)Н 2 ® 200 درجه سانتی گراد n H 2n+2 +nН 2 O
بنابراین، منابع اصلی آلکان ها گاز طبیعی و نفت هستند. با این حال، برخی از هیدروکربن های اشباع از ترکیبات دیگر سنتز می شوند.
کاربرد آلکان ها
بیشتر آلکان ها به عنوان سوخت استفاده می شوند. ترک خوردن و
هیدروژن زدایی آنها منجر به تولید هیدروکربن های غیر اشباع می شود که
که بسیاری از مواد آلی دیگر از آن به دست می آید.
متان بخش اصلی گازهای طبیعی (60-99%) است. قسمت
گازهای طبیعی شامل پروپان و بوتان است. هیدروکربن های مایع
به عنوان سوخت در موتورهای احتراق داخلی، خودروها، هواپیماها و غیره استفاده می شود. مخلوطی از مایع خالص شده
و آلکان جامد وازلین را تشکیل می دهد. آلکان های بالاتر هستند
مواد اولیه برای تولید مواد شوینده مصنوعی. آلکان های به دست آمده از ایزومریزاسیون در تولید بنزین و لاستیک با کیفیت بالا استفاده می شوند. در زیر نمودار استفاده از متان آورده شده است

سیکلوآلکان ها
ساختار
سیکلوآلکان ها هیدروکربن های اشباع شده ای هستند که مولکول های آنها حاوی حلقه بسته ای از اتم های کربن است.
سیکلوآلکان ها (سیکلوپارافین ها) یک سری همولوگ با فرمول کلی C n H 2 n تشکیل می دهند که اولین عضو در آن است.
سیکلوپروپان C 3 H 6، زیرا برای تشکیل یک حلقه، حداقل باید سه اتم کربن وجود داشته باشد.
سیکلوآلکان ها چندین نام دارند: سیکلوپارافین، نفتن، سیکلان، پلی متیلن. نمونه هایی از برخی اتصالات:

فرمول C n H 2 n مشخصه سیکلوپارافین ها است و دقیقاً همان فرمول سری همولوگ آلکن ها (هیدروکربن های غیراشباع دارای یک پیوند چندگانه) را توصیف می کند. از این می توان نتیجه گرفت که هر سیکلوآلکان با یک آلکن مربوطه ایزومر است - این نمونه ای از ایزومریسم "بین طبقاتی" است.
سیکلوآلکان ها بر اساس اندازه حلقه به تعدادی گروه تقسیم می شوند که دو مورد از آنها را در نظر می گیریم: چرخه های کوچک (C 3, C 4) و معمولی (C 5 - C 7).
نام سیکلوآلکان ها با افزودن پیشوند cyclo- به نام آلکان با تعداد متناظر اتم های کربن ساخته می شود. شماره گذاری در چرخه به گونه ای انجام می شود که جایگزین ها کمترین اعداد را دریافت کنند.
فرمولهای ساختاری سیکلوآلکانها معمولاً به صورت مختصر نوشته میشوند و از شکل هندسی حلقه استفاده میکنند و نمادهای اتمهای کربن و هیدروژن را حذف میکنند. مثلا:

ایزومری ساختاری سیکلوآلکان ها با اندازه حلقه (سیکلوبوتان و متیل سیکلوپروپان ایزومرها هستند) و موقعیت جانشین ها در حلقه (به عنوان مثال، 1،1- و 1،2-دی متیل بوتان)، و همچنین ساختار آنها تعیین می شود. .
ایزومر فضایی نیز مشخصه سیکلوآلکان ها است، زیرا با آرایش های متفاوتی از جانشین ها نسبت به صفحه حلقه همراه است. هنگامی که جانشین ها در یک طرف صفحه حلقه قرار می گیرند، ایزومرهای سیس و ایزومرهای ترانس در دو طرف مقابل به دست می آیند.
هیدروکربن های اشباع شده- اینها هیدروکربن هایی هستند که مولکول های آنها فقط دارای پیوندهای ساده (تک) (-bonds) هستند. هیدروکربن های اشباع آلکان ها و سیکلوآلکان ها هستند.
اتم های کربن در هیدروکربن های اشباع در حالت هیبریداسیون sp 3 هستند.
آلکان ها- هیدروکربن های اشباع که ترکیب آنها با فرمول کلی C بیان می شود nاچ 2n+2. آلکان ها هیدروکربن های اشباع شده هستند.
ایزومرها و همولوگ ها
| جی | CH 4 متان |
||||
| CH 3 - CH 3 اتان |
|||||
| CH 3 -CH 2 -CH 3 پروپان |
|||||
| CH 3 —(CH 2) 2 —CH 3 بوتان |
2- متیل پروپان |
||||
| CH 3 —(CH 2) 3 —CH 3 پنتان |
2- متیل بوتان |
2،2-دی متیل پروپان |
|||
| CH 3 —(CH 2) 4 —CH 3 هگزان |
2- متیل پنتان |
2،2-دی متیل بوتان |
2،3-دی متیل بوتان |
3- متیل پنتان |
|
| ایزومرها | |||||
خواص فیزیکی آلکان ها
در دمای اتاق، C 1 - C 4 گاز، C 5 - C 15 مایع، C 16 و موارد زیر جامد هستند. نامحلول در آب؛ چگالی کمتر از 1 گرم بر سانتی متر مکعب؛ مایع - با بوی بنزین.
با افزایش تعداد اتم های کربن در یک مولکول، نقطه جوش افزایش می یابد.
خواص شیمیایی آلکان ها
فعالیت کم در شرایط عادی، با محلول های اسیدها و قلیاها واکنش نشان ندهید، محلول KMnO 4 و آب برم را تغییر رنگ دهید.
>تهیه آلکان ها
>>سیکلوآلکان ها- هیدروکربن های اشباع که ترکیب آنها با فرمول C بیان می شود n H 2 n. مولکول های سیکلوآلکان حاوی زنجیره های کربن بسته (چرخه) هستند.
ایزومرها و همولوگ ها
| جی | سیکلوپروپان C 3 H 6 یا |
||||
| سیکلوبوتان C4H8 یا |
متیل سیکلوپروپان |
||||
| سیکلوپنتان C 5 H 10 یا |
متیل سیکلوبوتان |
1،1-دی متیل سیکلوپروپان |
1،2-دی متیل سیکلوپروپان |
اتیل سیکلوپروپان |
|
| ایزومرها | |||||
ساده شده، چرخه هیدروکربن اغلب به صورت یک چندضلعی منظم با تعداد زاویه مناسب به تصویر کشیده می شود.
خواص فیزیکی کمی با خواص آلکان ها متفاوت است.
خواص شیمیایی
به استثنای سیکلوپروپان و سیکلوبوتان، سیکلوآلکان ها مانند آلکان ها در شرایط عادی غیر فعال هستند.
خواص کلی سیکلوآلکان ها (به عنوان مثال از سیکلوهگزان استفاده کنید):
>خواص ویژه سیکلوپروپان و سیکلوبوتان (تمایل به واکنش های افزودن):
روشهای بدست آوردن سیکلوآلکانها
الگوریتم تدوین نام هیدروکربن های اشباع
- ستون فقرات کربن را پیدا کنید: طولانی ترین زنجیره اتم های کربن است.
- اتم های کربن را در زنجیره اصلی شماره گذاری کنید، از انتهای نزدیک به شاخه شروع کنید.
- تعداد اتم کربن در زنجیره اصلی که جانشین دارد را مشخص کنید و نام جانشین را ذکر کنید. اگر چندین جایگزین وجود دارد، آنها را بر اساس حروف الفبا مرتب کنید. قبل از نام جانشینهای یکسان، تعداد تمام اتمهای کربن را که به آنها پیوند دارند مشخص کنید و از پیشوندهای ضرب (di-, tri-, tetra-) استفاده کنید.
- نام زنجیره اصلی را با پسوند -an بنویسید. ریشه نام های زنجیره اصلی: C 1 - met، C 2 - et، C 3 - prop، C 4 - but، C 5 - pent، C 6 - hex، C 7 - hep، C 8 - okt، C 9 - غیر، از 10 - دسامبر. نام سیکلوآلکان های جایگزین نشده از نام هیدروکربن اشباع با افزودن پیشوند سیکلو- تشکیل شده است. اگر در یک سیکلوآلکان جانشینهایی وجود داشته باشد، اتمهای کربن در حلقه از سادهترین جانشین (قدیمیترین، متیل) به پیچیدهتر به کوتاهترین شکل شمارهگذاری میشوند و موقعیت جانشینها به همان شکلی که در نشان داده میشود نشان داده میشود. آلکان ها
وظایف و آزمایشات با موضوع "موضوع 1. "هیدروکربن های اشباع"."
- هیدروکربن ها پلیمرها - مواد آلی درجه 8-9
درس: 7 تکلیف: 9 تست: 1
- - انسان در دنیای مواد، مواد و واکنش های شیمیایی، درجه 8-9
درس: 2 تکلیف: 6 تست: 1
- طبقه بندی مواد - طبقات مواد معدنی درجه 8-9
درس: 2 تکلیف: 9 تست: 1
آ.با توجه به ویژگی های یک ماده شرکت کننده در واکنش (جرم، حجم، مقدار ماده)، باید ویژگی های یک ماده دیگر را بیابید.مثال.جرم کلر مورد نیاز برای کلرزنی مرحله اول 11.2 لیتر متان را تعیین کنید.
پاسخ: متر(Cl 2) = 35.5 گرم.
ب.محاسبات با استفاده از قانون نسبت حجمی گازها.
مثال.تعیین کنید که برای احتراق کامل 10 متر مکعب پروپان (n.o).
پاسخ: V(O 2) = 50 متر 3.پس از اطمینان از تسلط بر همه چیزهایی که نیاز دارید، به انجام کارهای مبحث 1 ادامه دهید. برای شما آرزوی موفقیت داریم.
خواندن توصیه می شود:- O. S. Gabrielyan و دیگران. شیمی کلاس دهم. M., Bustard, 2002;
- L. S. Guzey، R. P. Surovtseva، G. G. Lysova. شیمی پایه یازدهم. باستارد، 1999.
- G. G. Lysova. یادداشت ها و تست های پایه در شیمی آلی. M.، Glik Plus LLC، 1999.
هیدروکربن های اشباع ترکیباتی هستند که مولکول هایی متشکل از اتم های کربن در حالت هیبریداسیون sp 3 هستند. آنها منحصراً توسط پیوندهای سیگما کووالانسی به یکدیگر متصل می شوند. نام هیدروکربن های "اشباع" یا "اشباع" از این واقعیت ناشی می شود که این ترکیبات توانایی اتصال هیچ اتمی را ندارند. آنها افراطی هستند، کاملا اشباع شده اند. استثنا سیکلوآلکان ها هستند.
آلکان چیست؟
آلکان ها هیدروکربن های اشباع هستند و زنجیره کربنی آنها باز است و از اتم های کربنی تشکیل شده است که با استفاده از پیوندهای منفرد به یکدیگر متصل شده اند. حاوی پیوندهای دیگر (یعنی دوگانه، مانند آلکن، یا سه گانه، مانند آلکیل) نیست. آلکان ها را پارافین نیز می نامند. آنها این نام را دریافت کردند زیرا پارافین های شناخته شده مخلوطی از این هیدروکربن های اشباع C 18 - C 35 با بی اثری خاص هستند.
اطلاعات کلی در مورد آلکان ها و رادیکال های آنها
فرمول آنها: C n P 2 n + 2، در اینجا n بزرگتر یا مساوی 1 است. جرم مولی با استفاده از فرمول محاسبه می شود: M = 14n + 2. ویژگی مشخصه: انتهای نام آنها "-an" است. بقایای مولکول های آنها که در نتیجه جایگزینی اتم های هیدروژن با اتم های دیگر به وجود می آیند رادیکال های آلیفاتیک یا آلکیل نامیده می شوند. آنها با حرف R مشخص می شوند. فرمول کلی رادیکال های آلیفاتیک تک ظرفیتی: C n P 2 n + 1، در اینجا n بزرگتر یا مساوی با 1 است. جرم مولی رادیکال های آلیفاتیک با فرمول M = 14n + محاسبه می شود. 1. یک ویژگی مشخصه رادیکال های آلیفاتیک: انتهای نام های "- سیلت". مولکول های آلکان ویژگی های ساختاری خود را دارند:
- پیوند C-C با طول 0.154 نانومتر مشخص می شود.
- پیوند C-H با طول 0.109 نانومتر مشخص می شود.
- زاویه پیوند (زاویه بین پیوندهای کربن و کربن) 109 درجه و 28 دقیقه است.

آلکان ها سری همولوگ را آغاز می کنند: متان، اتان، پروپان، بوتان و غیره.
خواص فیزیکی آلکان ها
آلکان ها مواد بی رنگ و نامحلول در آب هستند. دمایی که در آن آلکان ها شروع به ذوب شدن می کنند و دمای جوش آنها متناسب با افزایش وزن مولکولی و طول زنجیره هیدروکربنی افزایش می یابد. از آلکان های کم انشعاب به آلکان های بیشتر، نقطه جوش و ذوب کاهش می یابد. آلکان های گازی می توانند با شعله آبی کم رنگ یا بی رنگ بسوزند و گرمای بسیار زیادی تولید کنند. CH 4 -C 4 H 10 گازهایی هستند که بویی نیز ندارند. C 5 H 12 -C 15 H 32 مایعاتی هستند که بوی خاصی دارند. C 15 H 32 و غیره جامداتی هستند که بی بو نیز هستند.
خواص شیمیایی آلکان ها
این ترکیبات از نظر شیمیایی غیر فعال هستند، که می توان آن را با استحکام پیوندهای سیگما که به سختی شکسته می شوند - C-C و C-H توضیح داد. همچنین قابل توجه است که پیوندهای C-C غیر قطبی هستند و پیوندهای C-H قطبی پایین هستند. اینها انواع پیوندهای کم پلاریزه هستند که متعلق به نوع سیگما هستند و بر این اساس، به احتمال زیاد توسط یک مکانیسم همولیتیک شکسته می شوند و در نتیجه رادیکال ها تشکیل می شوند. بنابراین، خواص شیمیایی آلکان ها عمدتا به واکنش های جایگزینی رادیکال محدود می شود.

واکنش های نیتراسیون
آلکان ها فقط با اسید نیتریک با غلظت 10 درصد یا با اکسید نیتروژن چهار ظرفیتی در محیط گازی در دمای 140 درجه سانتی گراد واکنش می دهند. واکنش نیتراسیون آلکان ها را واکنش کونوالوف می نامند. در نتیجه ترکیبات نیترو و آب تشکیل می شود: CH 4 + اسید نیتریک (رقیق شده) = CH 3 - NO 2 (نیترومتان) + آب.
واکنش های احتراق
هیدروکربن های اشباع شده اغلب به عنوان سوخت استفاده می شوند، که با توانایی آنها در سوزاندن توجیه می شود: C n P 2n + 2 + ((3n + 1) / 2) O 2 = (n + 1) H 2 O + n CO 2.
واکنش های اکسیداسیون
خواص شیمیایی آلکان ها همچنین شامل توانایی آنها در اکسید شدن است. بسته به شرایطی که واکنش را همراهی می کند و چگونه تغییر می کند، محصولات نهایی متفاوتی را می توان از یک ماده به دست آورد. اکسیداسیون ملایم متان با اکسیژن در حضور کاتالیزوری که واکنش را تسریع می کند و دمای حدود 200 درجه سانتیگراد می تواند منجر به مواد زیر شود:
1) 2CH 4 (اکسیداسیون با اکسیژن) = 2CH 3 OH (الکل - متانول).
2) CH 4 (اکسیداسیون با اکسیژن) = CH 2 O (آلدهید - متانال یا فرمالدئید) + H 2 O.
3) 2CH 4 (اکسیداسیون با اکسیژن) = 2HCOOH (اسید کربوکسیلیک - متان یا فرمیک) + 2H 2 O.

همچنین، اکسیداسیون آلکان ها را می توان در یک محیط گازی یا مایع با هوا انجام داد. چنین واکنش هایی منجر به تشکیل الکل های چرب بالاتر و اسیدهای مربوطه می شود.
رابطه با گرما
در دمای بیش از 150-250 درجه سانتیگراد، همیشه در حضور یک کاتالیزور، یک بازآرایی ساختاری مواد آلی رخ می دهد که شامل تغییر در ترتیب اتصال اتم ها است. به این فرآیند ایزومریزاسیون و مواد حاصل از واکنش را ایزومر می گویند. بنابراین، از بوتان معمولی، ایزومر آن - ایزوبوتان به دست می آید. در دمای 300-600 درجه سانتیگراد و حضور یک کاتالیزور، پیوندهای C-H با تشکیل مولکول های هیدروژن (واکنش های هیدروژن زدایی)، مولکول های هیدروژن با بسته شدن زنجیره کربن به یک چرخه (واکنش های چرخه ای یا آروماتیزاسیون آلکان ها) شکسته می شوند. :
1) 2CH 4 = C 2 H 4 (اتن) + 2H 2.
2) 2CH 4 = C 2 H 2 (اتین) + 3H 2.
3) C 7 H 16 (هپتان معمولی) = C 6 H 5 - CH 3 (تولوئن) + 4 H 2.

واکنش های هالوژناسیون
چنین واکنش هایی شامل ورود هالوژن ها (اتم های آنها) به مولکول یک ماده آلی و در نتیجه تشکیل پیوند C-هالوژن است. هنگامی که آلکان ها با هالوژن ها واکنش می دهند، مشتقات هالوژن تشکیل می شوند. این واکنش ویژگی های خاصی دارد. طبق یک مکانیسم رادیکال پیش می رود و برای شروع آن باید مخلوط هالوژن ها و آلکان ها را در معرض اشعه ماوراء بنفش قرار داد یا به سادگی آن را گرم کرد. خواص آلکان ها اجازه می دهد تا واکنش هالوژناسیون ادامه یابد تا زمانی که جایگزینی کامل با اتم های هالوژن حاصل شود. یعنی کلرزنی متان به یک مرحله و تولید متیل کلرید ختم نمی شود. واکنش فراتر می رود، تمام محصولات جایگزین ممکن تشکیل می شود، که با کلرومتان شروع می شود و با تتراکلرید کربن پایان می یابد. قرار گرفتن در معرض سایر آلکان ها در برابر کلر در این شرایط منجر به تشکیل محصولات مختلف ناشی از جایگزینی هیدروژن در اتم های کربن مختلف می شود. دمایی که در آن واکنش رخ می دهد، نسبت محصولات نهایی و سرعت تشکیل آنها را تعیین می کند. هرچه زنجیره هیدروکربنی آلکان طولانی تر باشد، واکنش آسان تر خواهد بود. در طول هالوژناسیون، ابتدا اتم کربن کم هیدروژنه (ثالثیه) جایگزین می شود. اولی بعد از بقیه واکنش نشان خواهد داد. واکنش هالوژناسیون در مراحل انجام می شود. در مرحله اول فقط یک اتم هیدروژن جایگزین می شود. آلکان ها با محلول های هالوژن (آب کلر و برم) برهم کنش ندارند.

واکنش های سولفوکلریناسیون
خواص شیمیایی آلکان ها نیز با واکنش سولفوکلریناسیون (که واکنش رید نامیده می شود) تکمیل می شود. هنگامی که آلکان ها در معرض اشعه ماوراء بنفش قرار می گیرند، می توانند با مخلوطی از کلر و دی اکسید گوگرد واکنش نشان دهند. در نتیجه، کلرید هیدروژن و همچنین یک رادیکال آلکیل تشکیل می شود که دی اکسید گوگرد را اضافه می کند. نتیجه یک ترکیب پیچیده است که به دلیل گرفتن اتم کلر و تخریب مولکول بعدی آن پایدار می شود: R-H + SO 2 + Cl 2 + اشعه ماوراء بنفش = R-SO 2 Cl + HCl. سولفونیل کلریدهای تشکیل شده در نتیجه واکنش به طور گسترده در تولید سورفکتانت ها استفاده می شود.
آلکان ها از فرآورده های نفتی، گاز طبیعی و زغال سنگ به دست می آیند. کاربرد اصلی آلکان ها به عنوان سوخت است. از این مواد برای ساخت حلال ها، لوازم آرایشی و آسفالت نیز استفاده می شود.
شرح
آلکان ها دسته ای از هیدروکربن های اشباع یا اشباع هستند. این بدان معنی است که مولکول های آلکان دارای حداکثر تعداد اتم های هیدروژن هستند. فرمول کلی ترکیبات سری همولوگ آلکان ها C n H 2n+2 است. نام مواد از اعداد یونانی و پسوند -an تشکیل شده است.
خواص فیزیکی و شیمیایی آلکان ها به ساختار آنها بستگی دارد. با افزایش تعداد اتم های کربن در یک مولکول، انتقال از مواد گازی به ترکیبات جامد رخ می دهد.
وضعیت فیزیکی آلکان ها بسته به تعداد اتم های کربن:
- ج 1 - ج 4- گازها؛
- از 5 تا 15- مایعات؛
- از 16 - از 390- مواد جامد.
گازها با شعله آبی می سوزند و مقدار زیادی گرما آزاد می کنند. آلکان های حاوی 18-35 اتم کربن، مواد مومی و نرم هستند. شمع های پارافینی از مخلوط آنها ساخته می شوند.

برنج. 1. شمع پارافین.
با افزایش وزن مولکولی در سری های همولوگ، نقطه ذوب و جوش افزایش می یابد.
کاربرد
آلکان ها از مواد معدنی - نفت، گاز، زغال سنگ جدا می شوند. در مراحل مختلف فرآوری، بنزین، نفت سفید و نفت کوره به دست می آید. آلکان ها در پزشکی، زیبایی و ساختمان سازی استفاده می شوند.

برنج. 2. روغن حاوی آلکان مایع است.
جدول زمینه های اصلی کاربرد هیدروکربن های اشباع را شرح می دهد.
|
منطقه |
آنچه استفاده می شود |
نحوه استفاده |
|
صنعت انرژی |
بنزین، نفت سفید، نفت کوره |
به عنوان سوخت موشک و موتور |
|
آلکان های گازی |
به عنوان گاز خانگی برای پخت و پز |
|
|
صنایع شیمیایی |
نفت اتر (مخلوطی از ایزوپنتان ها و ایزوهگزان ها) |
تولید حلال ها، روغن های روان کننده، اشباع |
|
تولید ژله نفتی (مخلوطی از آلکان مایع)، ژله نفتی (مخلوط آلکان مایع و جامد)، شمع، مواد شوینده، لاک، لعاب، صابون. به عنوان اشباع برای کبریت. استفاده در تولید اسیدهای آلی |
||
|
آلکان های کلردار |
تولید الکل، آلدئید، اسید |
|
|
زیبایی شناسی |
وازلین، وازلین |
تولید پماد |
|
به عنوان پیشران برای ساخت ذرات معلق در هوا |
||
|
تولید لوازم آرایشی مرطوب کننده |
||
|
ساخت و ساز |
قطران محصول نهایی پالایش نفت است که حاوی مخلوطی از آلکان ها، سیکلوآلکان ها، آرن ها، فلزات و غیرفلزات است. |
برای تولید جاده های آسفالته |
|
صنعت کاغذ و خمیر کاغذ |
به عنوان اشباع برای کاغذ بسته بندی |
|
|
صنایع غذایی |
تولید آدامس |

برنج. 3. قیر.
آلکان ها در ساخت لاستیک، پارچه های مصنوعی، پلاستیک و سورفکتانت ها استفاده می شوند. پروپان و بوتان به صورت مایع برای پر کردن مجدد سیلندرهای اطفاء حریق استفاده می شود.
ما چه آموخته ایم؟
به طور خلاصه با کاربردهای آلکان آشنا شدیم. هیدروکربن های اشباع در حالت های گازی، مایع و جامد در صنایع شیمیایی، غذایی، کاغذ، انرژی، آرایشی و بهداشتی و ساخت و ساز استفاده می شود. آلکان ها برای تولید حلال ها، رنگ ها، لاک ها، صابون ها، شمع ها، پمادها و آسفالت استفاده می شوند. بنزین، نفت سفید و نفت کوره متشکل از آلکان های مایع به عنوان سوخت استفاده می شود. آلکان های گازی در زندگی روزمره و برای تولید آئروسل ها استفاده می شوند. منابع اصلی آلکان ها نفت، گاز طبیعی و زغال سنگ است.
محتوای مقاله
آلکان ها و سیکلوآلکان ها- هیدروکربن هایی که در آنها همه اتم های کربن با پیوندهای ساده (تک) به یکدیگر و به اتم های هیدروژن متصل هستند. آلکان ها (مترادف ها - هیدروکربن های اشباع، هیدروکربن های اشباع، پارافین ها) - هیدروکربن ها با فرمول کلی C n H 2 n+2، کجا n- تعداد اتم های کربن پلی اتیلن آشنا همان فرمول را دارد، فقط اندازه nبسیار بزرگ است و می تواند به ده ها هزار نفر برسد. علاوه بر این، پلی اتیلن حاوی مولکول هایی با طول های مختلف است. در سیکلوآلکان ها، اتم های کربن یک زنجیره بسته را تشکیل می دهند. اگر یک چرخه وجود داشته باشد، فرمول سیکلوآلکان C است n H 2 n .
بسته به ترتیب اتصال اتم های کربن در یک زنجیره، آلکان ها به خطی و شاخه ای تقسیم می شوند. بر این اساس، برای آلکان با n 4 ممکن است بیش از یک ماده با فرمول یکسان وجود داشته باشد. چنین موادی ایزومر نامیده می شوند (از یونانی. isis– مساوی، یکسان و meros – سهم، جزء.
نام آلکان ها
کلمه "آلکان" از همان ریشه "الکل" است. زیر را ببینید). اصطلاح منسوخ "پارافین" از واژه لاتین parum - کمی، ناچیز و affinis - مربوط می آید. پارافین ها نسبت به اکثر معرف های شیمیایی واکنش پذیری کمی دارند. بسیاری از پارافین ها همولوگ هستند. در سری همولوگ آلکان ها، هر عضو بعدی با گروه قبلی یک گروه متیلن CH 2 متفاوت است. این اصطلاح از واژه یونانی homologos - متناظر، مشابه گرفته شده است.
نامگذاری (از لات. نامگذاری- فهرست اسامی) نام آلکان ها بر اساس قوانین خاصی ساخته می شوند که همیشه بدون ابهام نیستند. بنابراین، اگر در یک مولکول آلکان جانشین های مختلفی وجود داشته باشد، در نام آلکان به ترتیب حروف الفبا فهرست می شوند. با این حال، این ترتیب ممکن است در زبان های مختلف متفاوت باشد. برای مثال، هیدروکربن CH 3 –CH(CH3)–CH(C2H5)–CH2–CH2–CH3 مطابق با این قانون در روسی 2-متیل-3-اتیل هگزان نامیده می شود و در انگلیسی 3-اتیل-2-متیل هگزان…
مطابق با نام هیدروکربن، رادیکال های آلکیل نیز نامیده می شوند: متیل (CH 3 -)، اتیل (C 2 H 5 -)، ایزوپروپیل (CH 3) 2 CH-، سه شنبه-بوتیل C 2 H 5 - CH (CH 3) -، مالش-بوتیل (CH 3) 3 C- و غیره رادیکال های آلکیل به طور کلی در ترکیب بسیاری از ترکیبات آلی گنجانده شده اند. در حالت آزاد، این ذرات با یک الکترون جفت نشده بسیار فعال هستند.
برخی از ایزومرهای آلکان ها نیز نام های بی اهمیتی دارند ( سانتی متر. اسامی مواد بی اهمیت، به عنوان مثال ایزوبوتان (2-متیل پروپان)، ایزواکتان (2،2،4-تری متیل پنتان)، نئوپنتان (2،3-دی متیل پروپان)، اسکوالان (2،6،10،15،19،23-هگزا متیل تتراکوزان)، نام از لاتین آمده است اسکوالوس– کوسه (مشتق غیراشباع اسکوالان – اسکوالن، ترکیبی مهم برای متابولیسم، اولین بار در کبد کوسه کشف شد). نام ساده رادیکال پنتیل (C 5 H 11) آمیل است. از یونانی می آید. آمیلون– نشاسته: روزی روزگاری ایزوآمیل الکل C 5 H 11 OH (3- متیل بوتانول-1) را "آمیل الکل تخمیر" می نامیدند، زیرا اساس روغن فوزل را تشکیل می دهد و در نتیجه تخمیر تشکیل می شود. مواد قندی - محصولات هیدرولیز نشاسته.
ساده ترین عضو سری سیکلوآلکان C n H 2 n– سیکلوپروپان ( n= 3). همولوگ های آن با افزودن پیشوند "سیکلو" (سیکلوبوتان، سیکلوپنتان و غیره) مانند آلکان ها نامیده می شوند. در سیکلوآلکان ها ایزومریسم به دلیل وجود گروه های آلکیل جانبی و قرار گرفتن آنها در حلقه امکان پذیر است. به عنوان مثال، سیکلوهگزان، متیل سیکلوپنتان، 1،1-، 1،2- و 1،3-دی متیل سیکلوبوتان ها، 1،1،2- و 1،2،3-تری متیل سیکلوپروپان ها ایزومر هستند.
با افزایش تعداد اتم های کربن، تعداد ایزومرهای آلکان به شدت افزایش می یابد. نام برخی از آلکان ها و همچنین تعداد نظری ایزومرهای احتمالی آنها در جدول آورده شده است.
| فرمول | نام | تعداد ایزومرها | فرمول | نام | تعداد ایزومرها |
| CH 4 | متان | 1 | C 11 N 24 | آندکان | 159 |
| C 2 H 6 | اتان | 1 | C 12 N 26 | دودکان | 355 |
| C 3 H 8 | پروپان | 1 | C 13 N 28 | تریدکان | 802 |
| C 4 H 10 | بوتان | 2 | C 14 N 30 | تترادکان | 1858 |
| C 5 H 12 | پنتان | 3 | C 15 N 32 | پنتادکان | 4347 |
| C 6 H 14 | هگزان | 5 | C 20 N 42 | ایکوسان | 366319 |
| C 7 H 16 | هپتان | 9 | C 25 N 52 | پنتاکوسان | 36797588 |
| C 8 H 18 | اکتان | 18 | C 30 N 62 | تریاکونتان | 4111846763 |
| C 9 H 20 | نونان | 35 | C 40 N 82 | تتراکنتان | 62481801147341 |
| C 10 H 22 | دین | 75 | C 100 N 202 | هکتان | حدود 5.921 10 39 |
درک بیشتر نامهای نامگذاری هیدروکربنهای اشباع شده، حتی برای کسانی که یونانی را در یک ورزشگاه کلاسیک مطالعه نکردهاند، چندان دشوار نیست. این نام ها از اعداد یونانی با اضافه کردن پسوند -an آمده اند. با اعضای اول سری دشوارتر است: آنها از اعداد استفاده نمی کنند، بلکه از ریشه های یونانی دیگر مرتبط با نام الکل ها یا اسیدهای مربوطه استفاده می کنند. این الکل ها و اسیدها مدت ها قبل از کشف آلکان های مربوطه شناخته شده بودند. به عنوان مثال اتیل الکل و اتان (فقط در سال 1848 به دست آمد).
متان (و همچنین متانول، متیل، متیلن و غیره) دارای یک ریشه مشترک "مت" است که در شیمی به گروهی حاوی یک اتم کربن اشاره می کند: متیل CH 3، متیلن (متیلیدن) CH 2، متین (متیلیدین) CH. از نظر تاریخی، اولین ماده ای از این دست متیل (همچنین به عنوان چوب) الکل، متانول بود که قبلاً از تقطیر خشک چوب به دست می آمد. نام آن از کلمات یونانی methy - برای مست کردن شراب و تپه - جنگل (به اصطلاح "شراب چوب") گرفته شده است. شگفت انگیزترین چیز در اینجا این است که متان، آمیتیست و عسل ریشه مشترکی دارند! در زمان های قدیم، سنگ های قیمتی دارای خواص جادویی بودند (و بسیاری هنوز به این باور دارند). بنابراین، اعتقاد بر این بود که سنگ های بنفش زیبا از مسمومیت محافظت می کنند، به خصوص اگر یک فنجان نوشیدنی از این سنگ ساخته شده باشد. همراه با پیشوند منفی معلوم شد که آمیتیستوس - مقابله با مسمومیت. به نظر می رسد کلمه عسل تقریباً در تمام زبان های اروپایی وجود دارد: انگلیسی. مید - عسل (به عنوان نوشیدنی)، آلمانی Met (در آلمانی باستان metu)، مد هلندی، mjöd سوئدی، mjød دانمارکی، لیتوانیایی و لتونی medus، بدون ذکر زبان های اسلاو. همه این کلمات، از جمله یونانی، از واژه هندو اروپایی medhu به معنای نوشیدنی شیرین آمده است. براندی یونانی متاکسا از آنها فاصله چندانی ندارد، اگرچه اصلا شیرین نیست.
اتان (و همچنین اتر، اتانول، الکل، آلکان) منشأ مشترکی دارند. فیلسوفان یونان باستان از کلمه Aither برای توصیف ماده خاصی استفاده می کردند که در کیهان نفوذ می کند. هنگامی که کیمیاگران در قرن هشتم. آنها مایعی را که به راحتی تبخیر می شد از الکل شراب و اسید سولفوریک بدست آوردند که به آن اتر سولفوریک می گفتند. در قرن 19 متوجه شد که اتر سولفوریک (به انگلیسی اتر) متعلق به به اصطلاح اترها است و شامل گروهی از دو اتم کربن است - همان الکل اتیلیک (اتانول). این گروه اتیل نام داشت. بنابراین، نام ماده "اتیل اتر" (C 2 H 5 - O - C 2 H 5) در اصل "روغن نفت" است.
نام اتان از اتیل گرفته شده است. یکی از نام های اتانول، الکل، منشأ مشابه کلمه آلکان (همچنین آلکن، آلکین، آلکیل) دارد. الکهل در زبان عربی به معنای پودر، پودر، غبار است. با کوچکترین نفس، آنها به هوا بلند می شوند، درست مانند بخارات شراب - "الکل شراب"، که با گذشت زمان به سادگی به الکل تبدیل می شود.
چرا "t" در "اتان" و "اتانول" و "f" در "اتر" وجود دارد؟ از این گذشته ، در انگلیسی ، بر خلاف روسی ، کلمات "اتر" و "اتیل" املا و صداهای مشابهی دارند. ترکیب th به حرف یونانی q (تتا) برمی گردد. در زبان روسی تا سال 1918، حرف "فیتا" به همین سبک بود، اما به صورت "f" تلفظ می شد و تنها برای تشخیص کلماتی که در آنها این حرف از یونانی q و 247 می آید استفاده می شد. فی»). در زبان های اروپای غربی یونانی. j به ph و q به th رفت. در زبان روسی، بسیاری از کلمات حاوی "فیتا" در قرن هجدهم هستند. با حرف «ف» جایگزین شد: تئاتر به جای قافتر، ریاضیات به جای «ماقامات»، نظریه به جای «قیوری»... از این نظر جالب است که در فرهنگ لغت دال، چاپ 1882، آمده است. eqir نوشته شده است و در فرهنگ لغت دایره المعارف بروکهاوس و افرون (1904) - "اتر".
به هر حال، استرها در زبان های غربی استر هستند، نه اتر. اما کلمه "استر" در زبان روسی وجود ندارد، بنابراین چشم هر شیمیدانی از ترجمه بی سواد پلی استر انگلیسی روی برچسب محصولات نساجی به عنوان "پلی استر" به جای "پلی استر"، "الیاف پلی استر" (پلی استرها) آسیب می بیند. به عنوان مثال، لاوسان، تریلن، داکرون).
نام های "پروپان" و "بوتان" از نام اسیدهای مربوطه - پروپیونیک و بوتانیک (بوتیریک) گرفته شده است. اسید پروپیونیک "اولین" (یعنی کوتاه ترین زنجیره) است که در چربی ها یافت می شود. سانتی متر. چربی ها و روغن ها) و نام آن از یونانی گرفته شده است. پروتوها- اول و پایون– چربی بوتان و اسید بوتانوئیک بوتیریک اسید) – از یونانی. بوتیرون- روغن؛ در زبان روسی، بوتیرات ها نمک ها و استرهای اسید بوتیریک هستند. این اسید زمانی که روغن فاسد می شود آزاد می شود.
علاوه بر این، با شروع با پنتان، نام ها از اعداد یونانی مشتق شده اند. یک استثنای نادر cetane است که یکی از نامهای C16 hexadecane است. این کلمه از نام ستیل الکل گرفته شده است که در سال 1823 توسط شیمیدان فرانسوی میشل اوژن شورول به دست آمد. Chevreul این ماده را از spermaceti، یک ماده مومی شکل از سر نهنگ اسپرم جدا کرد. کلمه spermaceti از یونانی sperma - دانه و ketos - حیوان دریایی بزرگ (نهنگ، دلفین) گرفته شده است. از املای لاتین کلمه دوم (cetus) ستیل الکل C 16 H 33 OH (هگزادکانول) و ستان می آید.
در زبان روسی کلمات زیادی با ریشه های مشابه آلکان ها وجود دارد: پنتاگون، هپتاکورد (مقیاس صدای 7 مرحله ای)، دوازده صدایی (روش آهنگسازی)، اکتاو، دسیما و آندسیما (فاصله های موسیقی)، اکتت و نونت (گروه های موسیقی). 8 و 9 نوازندگان)، پنتود، هگزود و هپتود (لوله های رادیویی)؛ هگزامتر (متر شاعرانه)، هشت وجهی، دهه، ده، هکتار، مهر، آذر و غیره. و غیره
آلکان با طولانی ترین مولکول ها توسط شیمیدانان انگلیسی در سال 1985 سنتز شد. محققان علاقه مند بودند که چگونه چنین زنجیره های طولانی در طول تبلور بسته می شوند (زنجیره های هیدروکربنی انعطاف پذیر می توانند به راحتی تا شوند).
تعداد ایزومرهای آلکان.
مشکل احتمالی تعداد ایزومرهای آلکان برای اولین بار توسط ریاضیدان انگلیسی آرتور کیلی (1821-1895)، یکی از بنیانگذاران شاخه مهم ریاضیات - توپولوژی حل شد (او در سال 1879 اولین مقاله را در مورد معروف منتشر کرد. مشکل چهار رنگ: آیا تعداد آنها برای رنگ آمیزی کارت های جغرافیایی کافی است؛ این مشکل تنها در سال 1976 حل شد). معلوم شد که هیچ فرمولی وجود ندارد که بتوان با استفاده از آن از تعداد اتم های کربن در یک آلکان C استفاده کرد n H 2 n+2 تعداد ایزومرهای آن را محاسبه کنید. فقط فرمول های به اصطلاح مکرر وجود دارد (از لاتین عودها- بازگشتی)، که به شما امکان می دهد تعداد ایزومرها را محاسبه کنید nاگر تعداد ایزومرهای عضو قبلی از قبل مشخص باشد، عضو سری است. بنابراین، محاسبات برای بزرگ nنسبتاً اخیراً با استفاده از رایانه به دست آمد و به هیدروکربن C 400 H 802 کاهش یافت. برای آن، با در نظر گرفتن ایزومرهای فضایی، مقداری به دست آمد که تصور آن دشوار است: 4.776·10 199. و با شروع از آلکان C 167 H 336، تعداد ایزومرها از تعداد ذرات بنیادی در بخش مرئی جهان که 1080 تخمین زده می شود، بیشتر است. تعداد ایزومرهای نشان داده شده در جدول برای اکثر آلکان ها به طور قابل توجهی افزایش می یابد اگر مولکول های متقارن آینه ای - استریو ایزومرها را نیز در نظر بگیریم. سانتی متر. ایزومری نوری): برای هپتان - از 9 تا 11، برای دکان - از 75 تا 136، برای ایکوزان - از 366،319 تا 3،396،844، برای هکتان - از 5.921 10 39 تا 1.373 10 46، و غیره.
از دیدگاه یک شیمیدان، تعداد ایزومرهای ساختاری هیدروکربن های اشباع شده تنها برای اولین اعضای سری مورد توجه عملی است. حتی برای یک آلکان نسبتا ساده که تنها حاوی یک و نیم دوجین اتم کربن است، تعداد زیادی ایزومر به دست نیامده است و بعید است که هرگز سنتز شوند. به عنوان مثال، آخرین ایزومر از 75 ایزومر تئوری دکان تنها در سال 1968 سنتز شد. و این برای اهداف عملی انجام شد - برای داشتن مجموعه ای کامل تر از ترکیبات استاندارد که توسط آن هیدروکربن های مختلف، به عنوان مثال، آنهایی که در نفت یافت می شوند، می توانند شناسایی شود. به هر حال، تمام 18 ایزومر اکتان ممکن در انواع مختلف روغن یافت شده است.
اما جالبترین چیز این است که، با شروع با هپتادکان C 17 H 36، در ابتدا فقط برخی از تعداد ایزومرهای ممکن از لحاظ نظری، سپس بسیاری، و در نهایت تقریباً همه نمونههای بارز «شیمی کاغذ» هستند. نمی تواند در واقعیت وجود داشته باشد. واقعیت این است که با افزایش تعداد اتم های کربن در مولکول های ایزومرهای شاخه ای، مشکلات جدی در بسته بندی فضایی ایجاد می شود. از این گذشته، ریاضیدانان اتم های کربن و هیدروژن را به عنوان نقاطی در نظر می گرفتند، در حالی که در واقع شعاع محدودی دارند. بنابراین، یک "توپ" متان دارای 4 اتم هیدروژن در "سطح" خود است که آزادانه روی آن قرار می گیرند. در نئوپنتان C(CH 3) 4 در حال حاضر 12 اتم هیدروژن در "سطح" وجود دارد که بسیار نزدیکتر به یکدیگر قرار دارند. اما هنوز جا برای قرار دادن آنها وجود دارد. اما برای آلکان 4 (C 17 H 36)، فضای کافی روی سطح برای قرار دادن تمام 36 اتم هیدروژن در 12 گروه متیل وجود ندارد. به راحتی می توان بررسی کرد که آیا یک تصویر صاف (یا حتی بهتر از آن، یک مدل سه بعدی از پلاستیک و کبریت می سازید) برای ایزومرهای مشابه، با حفظ ثبات طول پیوند C-C و C-H و تمام زوایای بین آنها). با رشد nمشکلات قرارگیری نیز برای اتم های کربن ایجاد می شود. در نتیجه علیرغم اینکه تعداد ایزومرهای ممکن با افزایش می باشد nبسیار سریع افزایش می یابد، سهم ایزومرهای "کاغذی" بسیار سریعتر رشد می کند. یک ارزیابی مبتنی بر کامپیوتر نشان داد که به عنوان nنسبت تعداد ایزومرهای واقعاً ممکن به تعداد ایزومرهای "کاغذی" به سرعت به صفر نزدیک می شود. به همین دلیل است که محاسبه تعداد دقیق ایزومرهای هیدروکربن های اشباع برای بزرگ n، که زمانی علاقه قابل توجهی را برانگیخت، اکنون فقط برای شیمیدانان اهمیت نظری دارد.
ساختار و خواص فیزیکی آلکان ها
آلکان ها دارای چهار اوربیتال هیبریدی sp 3 از اتم کربن هستند ( سانتی متر. اوربیتال ها) به سمت رئوس چهار وجهی با زاویه بین آنها حدود 109 درجه 28 اینچ هدایت می شوند - در این حالت است که دافعه بین الکترون ها و انرژی سیستم حداقل است. در نتیجه همپوشانی این اوربیتال ها با یکدیگر، و همچنین با س-اوربیتال های اتم های هیدروژن پیوندهای s C-C و C-H را تشکیل می دهند. این پیوندها در مولکول های آلکان کووالانسی غیر قطبی یا کم قطبی هستند.
آلکان ها به اتم های کربن اولیه (آنها فقط به یک اتم C همسایه پیوند دارند)، ثانویه (پیوند به دو اتم C)، سوم (پیوند به سه اتم C) و چهارتایی (پیوند به چهار اتم C) تقسیم می شوند. بنابراین، در 2،2-دی متیل-3-متیل پنتان CH 3 -C(CH3) 2-CH(CH3) - CH2-CH3 یک اتم کربن چهارتایی، یک سوم، یک ثانویه و پنج اتم اولیه کربن وجود دارد. محیط های مختلف اتم های کربن به شدت بر واکنش پذیری اتم های هیدروژن مرتبط با آنها تأثیر می گذارد.
آرایش فضایی اوربیتالهای sp 3، از پروپان شروع میشود، به یک پیکربندی زیگزاگی از زنجیرههای کربنی. در این حالت، چرخش قطعات مولکولی به دور پیوندهای C-C امکان پذیر است (در یک مولکول اتان در دمای 20 درجه سانتیگراد - با سرعت میلیون ها دور در ثانیه!)، که باعث انعطاف پذیری مولکول های آلکان های بالاتر می شود. صاف شدن چنین زنجیره هایی مثلاً هنگام کشش پلی اتیلن که از مخلوطی از آلکان ها با زنجیره های بلند تشکیل شده است اتفاق می افتد.مولکول های آلکان برهمکنش ضعیفی با یکدیگر دارند بنابراین آلکان ها در دمای بسیار پایین تری نسبت به مواد مشابه با مولکول های قطبی ذوب می شوند و می جوشند. 4 عضو اول سری همولوگ متان در شرایط عادی گاز هستند؛ پروپان و بوتان به راحتی تحت فشار کم مایع می شوند (مخلوط پروپان-بوتان مایع در سیلندرهای گاز خانگی موجود است). همولوگ های بالاتر مایعاتی با بوی بنزین یا جامداتی هستند که در آب نامحلول هستند و روی سطح آن شناور هستند. نقطه ذوب و جوش آلکان ها با افزایش تعداد اتم های کربن در مولکول افزایش می یابد، در حالی که افزایش دما به تدریج کاهش می یابد، به عنوان مثال، C 100 H 202 در دمای 115 درجه سانتی گراد، C 150 H 302 - در 123 درجه سانتی گراد ذوب می شود. و نقطه جوش برای 25 آلکان اول در جدول آورده شده است - واضح است که با شروع از اکتادکان، آلکان ها جامد هستند.
| جدول. دمای ذوب و جوش آلکان ها | ||
| آلکان | تی pl | تیعدل |
| متان | –182,5 | –161,5 |
| اتان | –183,3 | –88,6 |
| پروپان | –187,7 | –42,1 |
| بوتان | –138,4 | –0,5 |
| پنتان | –129,7 | 36,1 |
| هگزان | –95,3 | 68,7 |
| هپتان | –90,6 | 98,4 |
| اکتان | –56,8 | 125,7 |
| نونان | –51,0 | 150,8 |
| دین | –29,7 | 174,1 |
| آندکان | –25,6 | 195,9 |
| دودکان | –9,6 | 216,3 |
| تریدکان | –5,5 | 235,4 |
| تترادکان | +5,9 | 253,7 |
| پنتادکان | +9,9 | 270,6 |
| هگزادکان | 18,2 | 286,8 |
| هپتادکان | 22,0 | 301,9 |
| Octadecan | 28,2 | 316,1 |
| نونادکان | 32,1 | 329,7 |
| ایکوسان | 36,8 | 342,7 |
| ژنیکوزان | 40,5 | 356,5 |
| دوکوزان | 44,4 | 368,6 |
| تریکوزان | 47,6 | 378,3 |
| تتراکوزان | 50,9 | 389,2 |
| پنتاکوسان | 53,7 | 399,7 |
وجود یک شاخه در زنجیره به طور چشمگیری باعث تغییر خواص فیزیکی به خصوص نقطه ذوب می شود. بنابراین، اگر هگزان دارای ساختار طبیعی باشد ( nهگزان) در -95.3 درجه سانتی گراد ذوب می شود، سپس 2-متیل پنتان ایزومر آن در -153.7 درجه سانتی گراد ذوب می شود. این به دلیل دشواری بسته بندی مولکول های شاخه دار در طول تبلور آنها است. در نتیجه، آلکان های دارای شاخه های زنجیره ای با سرد شدن سریع متبلور نمی شوند، بلکه به حالت شیشه ای یک مایع فوق سرد تبدیل می شوند. سانتی متر. شیشه). به عنوان مثال، اگر یک آمپول نازک پنتان در نیتروژن مایع (دمای -196 درجه سانتیگراد) غوطه ور شود، این ماده به یک توده برف مانند سفید تبدیل می شود، در حالی که ایزوپنتان (2-متیل بوتان) به یک "شیشه" شفاف تبدیل می شود.
یک روش اصلی برای جداسازی آنها بر اساس تفاوت شکل هندسی آلکان های خطی و منشعب است: بلورهای اوره کانال هایی دارند که آلکان های با زنجیره مستقیم می توانند در آنها جای بگیرند، اما بلورهای منشعب نمی توانند.
سیکلوآلکان ها با n= 2، 3 - گازها، بالاتر - مایعات یا جامدات. بزرگترین چرخه ای که شیمیدانان توانسته اند سنتز کنند سیکلواکتاکتاکنتادیکتان C 288 H 576 است. شکلهای مختلف مولکولهای سیکلوآلکان با تعداد زوج و فرد اتمهای کربن در مولکول منجر به یک اثر زوج و فرد قوی در رابطه با نقطه ذوب میشود، همانطور که از جدول مشاهده میشود. این اثر با تفاوت در "راحتی" بسته بندی مولکول های اشکال مختلف در یک کریستال توضیح داده می شود: هرچه بسته بندی فشرده تر باشد، کریستال قوی تر و نقطه ذوب آن بالاتر می رود. به عنوان مثال، سیکلودودکان تقریباً 70 درجه بالاتر از نزدیکترین همولوگ خود، سیکلوندکان ذوب می شود. البته جرم مولکول نیز مهم است: مولکول های سبک در دمای پایین تری ذوب می شوند.
| C 3 H 6 | –127,5 |
| C 4 H 8 | –50 |
| C 5 H 10 | –93,9 |
| C 6 H 12 | +6,5 |
| C 7 H 14 | –12 |
| C 8 H 16 | 14,3 |
| S 9 H 18 | 9,7 |
| C 10 N 20 | 10,8 |
| C 11 N 22 | –7,2 |
| C 12 H 24 | 61,6 |
| C 13 N 26 | 23,5 |
| C 14 N 28 | 54 |
| C 15 N 30 | 62,1 |
سهولت چرخش در اطراف پیوند C-C منجر به این واقعیت می شود که مولکول های سیکلوآلکان ها مسطح نیستند (به استثنای سیکلوپروپان)، به این ترتیب از اعوجاج شدید زوایای پیوند جلوگیری می کنند. بنابراین، در سیکلوهگزان و همولوگ های بالاتر آن، زوایای پیوند شل و نزدیک به چهار وجهی (109 درجه) است، در حالی که در شش ضلعی زاویه ها 120 درجه، در یک هشت ضلعی - 135 درجه و غیره است. اتمهای کربن منفرد در چنین سیکلوآلکانیها موقعیت ثابتی را اشغال نمیکنند: به نظر میرسد حلقه در حرکت موجمانند ثابتی است. بنابراین، یک مولکول سیکلوهگزان میتواند به شکل ساختارهای هندسی مختلف (کنفرمکننده) باشد که میتوانند به یکدیگر تبدیل شوند (وارونگی چرخه). به دلیل شباهت بیرونی آنها به آنها "حمام" و "صندلی" می گفتند (در ادبیات انگلیسی به "حمام" "قایق" می گویند).
شکل صندلی پایدارتر است. در دماهای معمولی، 99.9 درصد سیکلوهگزان به شکل صندلی پایدارتر وجود دارد. انتقال بین دو شکل از طریق یک "ترکیب پیچشی" میانی (از انگلیسی. پیچ - پیچیدن- پیچ - پیچیدن).
در سیکلوپروپان، زاویه از 108 درجه به 60 درجه کاهش مییابد، که منجر به کشش بالا و پیوندهای خمیده میشود که میان پیوندهای معمولی s و p هستند. این پیوندها به دلیل شکلی که دارند، پیوندهای موزی نامیده می شوند. در این مورد، اوربیتالهای sp 3 اتمهای کربن فقط تا حدی همپوشانی دارند. نتیجه دوگانگی در خواص شیمیایی سیکلوپروپان است. از یک طرف، جایگزینی اتم های هیدروژن در آن امکان پذیر است (واکنشی معمول آلکان ها)، از طرف دیگر، افزودن با باز شدن حلقه امکان پذیر است (واکنش معمولی آلکن ها، به عنوان مثال: سیکلو-C 3 H 6 + Br 2 ® BrCH 2 CH 2 CH 2 Br).
سیکلوآلکان هایی که دارای دو حلقه و یک اتم کربن مشترک هستند، اسپیروآلکان نامیده می شوند. اگر بیش از دو اتم کربن مشترک وجود داشته باشد، دو حلقه آلکان، تری سیکلوآلکان و غیره تشکیل می شود. در نتیجه چنین "پیوند متقاطع" چندین چرخه به طور همزمان، شیمیدانان موفق به بدست آوردن هیدروکربن هایی شدند که ساختار فضایی آنها با انواع مختلف مطابقت دارد. چند وجهی: چهار وجهی، مکعب، منشور، و غیره. مشتقات دو حلقه ای سیکلوهگزان در اسانس، رزین مخروطی و سقز یافت می شود. چرخه ای از شش و پنج اتم کربن در کافور، کلسترول، ساخارین، پیپرین (طعم تند به فلفل سیاه می دهد)، بازهای نیتروژنی - نوکلئوتیدها و سایر ترکیبات (برخی اتم های کربن در چرخه ها را می توان با پیوندهای دوگانه به هم متصل کرد) یافت می شود. و برخی از اتم های دیگر جایگزین می شوند، مانند ساخارین). چرخه ای متشکل از 17 اتم کربن (دوتای آنها با یک پیوند دوگانه به هم متصل شده اند) در سیوتون وجود دارد، ماده ای خوشبو، جزء مشک، که در عطرسازی استفاده می شود. مولکول زیبای آدامانتان شامل سه حلقه شش عضوی است و ساختار آن مطابق با شبکه کریستالی الماس است. ساختار آدامانتان در داروی ضد ویروسی ریمانتادین، در هگزامتیلن تترامین (در ترکیب دوم، 4 اتم کربن با اتمهای نیتروژن جایگزین میشوند که توسط پلهای متیلن - CH 2 - به یکدیگر متصل میشوند) یافت میشود. در زیر ساختار برخی از سیکلوآلکان ها وجود دارد که مولکول های آنها بیش از یک حلقه به هم متصل دارند.
Bicyclodecane (تتراهیدرونافتالین، دکالین)
آدامتان
خواص شیمیایی آلکان ها
آلکان ها کم فعال ترین ترکیبات آلی هستند. همه پیوندهای C-C و C-H در آلکان ها منفرد هستند، بنابراین آلکان ها قادر به انجام واکنش های جمع نیستند. آلکان ها با واکنش های جایگزینی اتم های هیدروژن با سایر اتم ها و گروه های اتم مشخص می شوند. بنابراین، هنگامی که متان کلر می شود، متیل کلرید CH 3 Cl، متیلن کلرید CH 2 Cl 2، تری کلرومتان (کلروفرم) CHCl 3 و تتراکلرید کربن (تتراکلرید کربن) CCl 4 تشکیل می شود. این واکنش ها از یک مکانیسم زنجیره ای با تشکیل متوسط رادیکال های آزاد پیروی می کنند.
هنگام کلرزنی آلکان ها، با شروع پروپان، اولین اتم کلر می تواند جایگزین اتم های هیدروژن مختلف شود. جهت جانشینی به قدرت پیوند C-H بستگی دارد: هرچه ضعیف تر باشد، جایگزینی این اتم خاص سریعتر است. پیوندهای اولیه C-H معمولاً قویتر از پیوندهای ثانویه هستند و پیوندهای ثانویه از پیوندهای سوم قویتر هستند. در نتیجه، کلرزنی در 25 درجه سانتیگراد در امتداد پیوند ثانویه (CH 3) 2 CH-H 4.5 برابر سریعتر از پیوند اولیه C 2 H 5 -H و پیوند سوم (CH 3) 3 C-H - رخ می دهد. 6.7 برابر سریعتر واکنشپذیری متفاوت اتمهای هیدروژن اولیه، ثانویه و ثالثی میتواند منجر به غالب شدن تنها یکی از چندین محصول کلرزنی شود. به عنوان مثال، هنگامی که 2،3-دی متیل بوتان در محلول دی سولفید کربن (CS2) کلر می شود، 95٪ از مشتقات 2-chloro و تنها 5٪ از مشتقات 1-chloro تشکیل می شود، یعنی. 19 برابر کمتر اگر در نظر بگیریم که در آلکان اصلی 6 برابر اتم های هیدروژن اولیه بیشتر از اتم های سوم وجود دارد، نسبت واکنش پذیری آنها حتی بیشتر خواهد بود (19 ґ 6 = 114). دی سولفید کربن به عنوان یک حلال، واکنش پذیری اتم های کلر را کاهش می دهد و بر این اساس گزینش پذیری آن را افزایش می دهد. کاهش دما نیز به همین ترتیب عمل می کند.
اتم های برم کمتر فعال هستند. انرژی فعال سازی قابل توجه این واکنش منجر به این واقعیت می شود که برم شدن آلکان ها، اگرچه با مکانیسم زنجیره ای اتفاق می افتد، بسیار کندتر از کلرزنی است و فقط در دماهای بالا یا در نور است. فعالیت کمتر اتم های برم نیز منجر به افزایش گزینش پذیری برم می شود. بنابراین، اگر نرخ نسبی برماسیون فتوشیمیایی اتان در دمای 40 درجه سانتیگراد برابر با 1 در نظر گرفته شود، آنگاه نرخ برماسیون پروپان (در اتم H ثانویه) در شرایط مشابه 220 خواهد بود و سرعت برماسیون ایزوبوتان (در اتم H سوم) 19000 خواهد بود
اتم های ید کمترین فعالیت را دارند، بنابراین واکنش ید شدن آلکان های RH + I 2 ® RI + HI گرماگیر است، فقط در دماهای بالا امکان پذیر است و با زنجیره های بسیار کوتاه رخ می دهد. علاوه بر این، واکنش گرمازا معکوس RI + HI ® RH + I 2 بسیار آسان رخ می دهد. هنگامی که آلکان ها یددار می شوند، ترکیبات غیراشباع نیز تشکیل می شوند. به عنوان مثال، در دمای 685 درجه سانتیگراد، اتان در واکنش با ید، 72٪ اتیلن و 10٪ استیلن را تشکیل می دهد. نتایج مشابهی با پروپان، بوتان و پنتان به دست آمد.
واکنش فلوئوراسیون آلکان ها با سرعت بسیار بالا و اغلب انفجاری همراه با تشکیل تمام مشتقات پلی فلورینه ممکن آلکان اصلی انجام می شود. انرژی آزاد شده در طول فلوئوراسیون آلکان ها به قدری زیاد است که می تواند منجر به تجزیه مولکول های محصول به رادیکال هایی شود که زنجیره های جدیدی را آغاز می کند. در نتیجه سرعت واکنش مانند بهمن افزایش می یابد و این منجر به انفجار حتی در دماهای پایین می شود. ویژگی فلوئوراسیون آلکان ها امکان تخریب اسکلت کربن توسط اتم های فلوئور با تشکیل CF 4 به عنوان محصول نهایی با سایر هالوژن ها است، چنین واکنشی رخ نمی دهد.
نیتراسیون آلکان ها (واکنش کونوالوف) نیز از یک مکانیسم رادیکال پیروی می کند: RH + NO 2 ® R · + HNO 2، R · + NO 2 ® RNO 2. منبع NO 2 اسید نیتریک است که با حرارت دادن تجزیه می شود. واکنش در محلول در دمای بالاتر از 150 درجه سانتیگراد یا در بخار تحت فشار تا 10 اتمسفر و دمای 400 تا 500 درجه سانتیگراد انجام می شود. در حالت دوم، پیوندهای C-C در آلکان ها نیز شکسته شده و مخلوطی از نیتروآلکان تشکیل می شود.
همه آلکان ها با آزاد کردن گرما می سوزند، به عنوان مثال: C 5 H 12 + 8O 2 ® 5CO 2 + 6H 2 O. این واکنش به ویژه در سیلندرهای موتورهای احتراق داخلی رخ می دهد. برای جلوگیری از ورود بقایای آلکان های نسوخته به اتمسفر، از پس سوزی کاتالیزوری آنها در لوله های اگزوز استفاده می شود (در عین حال، CO سوزانده می شود و اکسیدهای نیتروژن به نیتروژن بی ضرر تبدیل می شوند). واکنش اکسیژن با آلکان های بالاتر (در پارافین) زمانی رخ می دهد که یک شمع می سوزد. آلکان های گازی مانند متان با هوا مخلوط های انفجاری تشکیل می دهند. اگر محتوای آن در هوا به 5٪ برسد، چنین مخلوط هایی می توانند در معادن و همچنین در ساختمان های مسکونی به دلیل نشت گاز خانگی تشکیل شوند.
تلاش های قابل توجه شیمیدانان با هدف مطالعه دقیق واکنش اکسیداسیون در دمای پایین آلکان ها به منظور متوقف کردن آن در مرحله تشکیل محصولات واسطه ای ارزشمند - آلدئیدها، کتون ها، الکل ها، اسیدهای کربوکسیلیک انجام شد. بنابراین، در حضور نمکهای Co(II) و منگنز (II)، بوتان میتواند به اسید استیک و پارافین به اسیدهای چرب C12-C18 اکسید شود. اکسیداسیون سیکلوهگزان باعث تولید کاپرولاکتام، مونومری برای تولید کاپرون و اسید آدیپیک می شود.
یک واکنش صنعتی مهم سولفوکلرین فتوشیمیایی آلکان ها است: یک واکنش زنجیره ای رادیکال مشترک با Cl 2 و SO 2 با تشکیل کلریدهای اسید آلکان سولفونیک RSO 2 Cl. این واکنش به طور گسترده در تولید مواد شوینده استفاده می شود. هنگام جایگزینی کلر با اکسیژن، یک واکنش رادیکال زنجیره ای اکسیداسیون سولفونیک آلکان ها با تشکیل اسیدهای آلکان سولفونیک R-SO 2-OH رخ می دهد. نمک سدیم این اسیدها به عنوان مواد شوینده و امولسیون کننده استفاده می شود.
در دماهای بالا، تجزیه (تجزیه در اثر حرارت) آلکان ها رخ می دهد، به عنوان مثال: CH 4 ® C + 2H 2 (1000 درجه سانتیگراد)، 2CH 4 ® C 2 H 2 + 3H 2 (1500 درجه سانتیگراد)، C 2 H 6 ® C 2 H 4 + H2. آخرین واکنش در دمای 500 درجه سانتیگراد در حضور کاتالیزور (Ni) انجام می شود. به طور مشابه، 2-بوتن CH 3 CH = CHCH 3 را می توان از بوتان به دست آورد، در همان زمان مخلوطی از اتیلن و اتان تشکیل می شود. برخلاف این واکنش رادیکال، ترک خوردگی کاتالیزوری آلکان ها از طریق مکانیسم یونی انجام می شود و برای تولید بنزین از بخش های نفتی سنگین تر عمل می کند. هنگامی که در حضور اسیدهای لوئیس، به عنوان مثال، AlCl 3، گرم می شود، ایزومریزاسیون اتفاق می افتد: آلکان های غیر شاخه ای (عادی) به آنهایی منشعب با همان تعداد اتم کربن تبدیل می شوند. این واکنش اهمیت عملی زیادی برای به دست آوردن سوخت موتور با کیفیت بالا دارد ( سانتی متر. عدد اکتان). هیدروژن زدایی آلکان ها می تواند با بسته شدن حلقه (دهیدروسیکل زدایی) همراه باشد. در مورد هیدروسایکل زدایی هگزان، محصول اصلی بنزن است.
متان در دمای بالا در حضور یک کاتالیزور با بخار آب و مونوکسید کربن (IV) واکنش می دهد تا گاز سنتز را تشکیل دهد: CH 4 + H 2 O ® CO + 3H 2، CH 4 + CO 2 ® 2CO + 2H 2. گاز سنتز برای تولید سوخت موتور و متیل الکل استفاده می شود.
در سالهای اخیر، تلاشهای شیمیدانان در جهت ایجاد کاتالیزورهایی بوده است که پیوندهای C-H را در مولکولهای آلکان در شرایط ملایم فعال میکنند. برخی از میکروارگانیسم ها "می توانند" چنین واکنش هایی را انجام دهند، آنزیم های آنها قادر به "هضم" حتی پارافین با تشکیل ترکیبات پروتئینی هستند. وظیفه شیمیدان ها درک نحوه عملکرد کاتالیزورهای طبیعی و مدل سازی واکنش های آنزیمی است که می توانند در دماهای معمولی رخ دهند. در این حالت از ترکیبات آلی فلزی مختلف به عنوان کاتالیزور استفاده می شود. به عنوان مثال، در حضور برخی از ترکیبات پلاتین، متانول CH3 OH را می توان مستقیماً از متان به دست آورد، و در حضور کمپلکس تری فنیل فسفین از رودیوم Rh[(C6H5)3P] مرتبط با مولکول های CO. در طول واکنش، مولکولهای CO وارد پیوندهای C-H آلکانها میشوند تا آلدئیدها را تشکیل دهند.
سیکلوآلکان ها خواص شیمیایی مشابه آلکان ها دارند. بنابراین، آنها قابل اشتعال هستند، می توانند با یک مکانیسم رادیکال هالوژنه شوند، و در دماهای بالا در حضور کاتالیزورها، هیدروژنه می شوند - هیدروژن را جدا می کنند و به هیدروکربن های غیر اشباع تبدیل می شوند. همانطور که گفته شد سیکلوپروپان خواص ویژه ای دارد. بر خلاف آلکان ها، سیکلوآلکان ها هیدروژنه می شوند، زمانی که حلقه باز می شود و آلکان ها تشکیل می شوند، به عنوان مثال: سیکلو-C 3 H 6 + H 2 ® C 3 H 8 (واکنش هنگام گرم شدن در حضور کاتالیزور پلاتین رخ می دهد). با افزایش اندازه چرخه، واکنش دشوارتر می شود - بنابراین، سیکلوپنتان در حال حاضر با سختی زیاد و در دمای بالا (300 درجه سانتیگراد) هیدروژنه می شود (به پنتان).
در طبیعت بودن و گرفتن.
منابع اصلی آلکان ها نفت و گاز طبیعی است. متان بخش عمده ای از گاز طبیعی را تشکیل می دهد؛ همچنین حاوی مقادیر کمی اتان، پروپان و بوتان است. متان در انتشار گازهای گلخانه ای از باتلاق ها و درزهای زغال سنگ یافت می شود. همراه با همولوگ های سبک، متان در گازهای نفتی مرتبط وجود دارد. این گازها تحت فشار در روغن حل می شوند و در بالای آن نیز قرار دارند. آلکان ها بخش قابل توجهی از فرآورده های نفتی را تشکیل می دهند. روغن همچنین حاوی سیکلوآلکان است - به آنها نفتن (از یونانی) می گویند. نفتا- روغن). هیدراتهای گازی آلکانها، عمدتاً متان، نیز در طبیعت گسترده هستند؛ آنها در سنگهای رسوبی در قارهها و در کف اقیانوسها وجود دارند. ذخایر آنها احتمالاً از ذخایر شناخته شده گاز طبیعی فراتر رفته و در آینده ممکن است به منبع متان و نزدیکترین همولوگ های آن تبدیل شوند.
آلکان ها نیز از طریق پیرولیز (کک سازی) زغال سنگ و هیدروژناسیون آن (تولید سوخت مایع مصنوعی) به دست می آیند. آلکان های جامد در طبیعت به صورت رسوبات موم کوهی - اوزوکریت، در پوشش های مومی برگ ها، گل ها و دانه های گیاهان یافت می شوند و جزء موم زنبور عسل هستند.
در صنعت، آلکان ها با هیدروژناسیون کاتالیستی اکسیدهای کربن CO و CO 2 (روش فیشر-تروپش) تولید می شوند. در آزمایشگاه، متان را می توان با حرارت دادن استات سدیم با یک قلیایی جامد: CH 3 COONa + NaOH ® CH 4 + Na 2 CO 3 و همچنین با هیدرولیز برخی کاربیدها: Al 4 C 3 + 12H 2 O ® 3CH به دست آورد. 4 + 4Al(OH) 3. همولوگ های متان را می توان با واکنش Wurtz به دست آورد، به عنوان مثال: 2CH 3 Br + 2Na ® CH 3 - CH 3 + 2NaBr. در مورد دی هالوآلکان ها، سیکلوآلکان ها به دست می آیند، به عنوان مثال: Br–CH 2 – (CH 2) 4 –CH 2 Br + 2Na ® سیکلو-C 6 H 12 + 2 NaBr. آلکان ها همچنین در طی کربوکسیلاسیون اسیدهای کربوکسیلیک و در طی الکترولیز آنها تشکیل می شوند.
کاربرد آلکان ها
آلکان های موجود در بنزین، نفت سفید، گازوئیل و نفت کوره به عنوان سوخت استفاده می شوند. آلکان های بالاتر در روغن های روان کننده، وازلین و پارافین یافت می شوند. مخلوطی از پنتان ها و هگزان های ایزومر را پترولیوم اتر می نامند و به عنوان حلال استفاده می شود. سیکلوهگزان همچنین به طور گسترده به عنوان حلال و برای سنتز پلیمرها (نایلون، نایلون) استفاده می شود. سیکلوپروپان برای بیهوشی استفاده می شود. اسکوالان یک روغن روان کننده با کیفیت بالا، جزء مواد دارویی و آرایشی و یک جاذب در کروماتوگرافی گازی مایع است.
آلکان ها به عنوان مواد خام برای تولید بسیاری از ترکیبات آلی از جمله الکل ها، آلدئیدها و اسیدها عمل می کنند. از مشتقات کلر آلکان ها به عنوان حلال استفاده می شود، به عنوان مثال، تری کلرومتان (کلروفرم) CHCl 3، تتراکلرید کربن CCl 4. مخلوطی از آلکان های بالاتر - پارافین غیر سمی است و به طور گسترده در صنایع غذایی برای آغشته کردن ظروف و مواد بسته بندی (مثلاً کارتن های شیر) و در تولید آدامس استفاده می شود. مدادها و قسمت بالایی (نزدیک سر) کبریت ها برای سوختن بهتر به پارافین آغشته می شوند. پارافین گرم شده برای اهداف دارویی (پارافین درمانی) استفاده می شود. اکسیداسیون پارافین در شرایط کنترل شده در حضور کاتالیزورها (نمک های فلزات واسطه آلی) منجر به تولید محصولات حاوی اکسیژن، عمدتا اسیدهای آلی می شود.
ایلیا لینسون
ادبیات:
پتروف A.A. شیمی آلکان ها. M.، Nauka، 1974
آذربایجان I.N. و غیره. سنتز بر اساس هیدروکربن های نفتی. آلما آتا، علم، 1974
روداکوف E.S. واکنش آلکان ها با عوامل اکسید کننده، کمپلکس های فلزی و رادیکال ها در محلول ها. کیف، ناوکوا دومکا، 1985
پاراوشانو وی. تولید و استفاده از هیدروکربن ها. م.، شیمی، 1987