अल्केन्स संक्षेप में। अल्केन्स: रासायनिक गुण
अल्केन्स के भौतिक गुण
सामान्य परिस्थितियों में, अल्केन्स की सजातीय श्रृंखला (सी 1 - सी 4) के पहले चार सदस्य गैसें हैं। पेंटेन से हेप्टाडेकेन (सी 5 - सी 17) तक के सामान्य अल्केन्स तरल होते हैं, सी 18 से शुरू होकर ऊपर ठोस होते हैं। जैसे-जैसे श्रृंखला में कार्बन परमाणुओं की संख्या बढ़ती है, अर्थात। जैसे-जैसे सापेक्ष आणविक भार बढ़ता है, अल्केन्स के क्वथनांक और गलनांक बढ़ते हैं।
अणु में कार्बन परमाणुओं की समान संख्या के साथ, शाखित अल्केन्स का क्वथनांक सामान्य अल्केन्स की तुलना में कम होता है।
अल्केन्स पानी में व्यावहारिक रूप से अघुलनशील होते हैं, क्योंकि उनके अणु निम्न-ध्रुवीय होते हैं और पानी के अणुओं के साथ परस्पर क्रिया नहीं करते हैं। तरल अल्केन्स एक दूसरे के साथ आसानी से मिल जाते हैं। वे गैर-ध्रुवीय कार्बनिक सॉल्वैंट्स जैसे बेंजीन, कार्बन टेट्राक्लोराइड आदि में अच्छी तरह से घुल जाते हैं।
संरचना
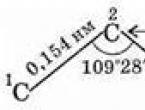
सबसे सरल अल्केन - मीथेन - के अणु में एक नियमित टेट्राहेड्रोन का आकार होता है, जिसके केंद्र में एक कार्बन परमाणु होता है, और शीर्ष पर हाइड्रोजन परमाणु होते हैं। सी-एच बांड के अक्षों के बीच का कोण 109°28" है (चित्र 29)।
अन्य संतृप्त हाइड्रोकार्बन के अणुओं में, बंधनों (सी-एच और सी-सी दोनों) के बीच के कोण का एक ही अर्थ होता है। अणुओं के आकार का वर्णन करने के लिए इसका उपयोग किया जाता है परमाणु कक्षकों के संकरण की अवधारणा(भाग I, §6 देखें)।
अल्केन्स में, सभी कार्बन परमाणु अवस्था में होते हैं एसपी 3 -संकरण (चित्र 30)।
इस प्रकार, कार्बन श्रृंखला में कार्बन परमाणु एक सीधी रेखा में नहीं हैं। पड़ोसी कार्बन परमाणुओं (परमाणुओं के नाभिक के बीच) के बीच की दूरी सख्ती से तय होती है - यह है रासायनिक बंधन की लंबाई(0.154 एनएम). दूरी सी 1 - सी 3, सी 2 - सी 4, आदि। (एक परमाणु के माध्यम से) भी स्थिर हैं, क्योंकि आबंधों के बीच का कोण स्थिर है - बंधन कोण.

एस-बॉन्ड के चारों ओर घूमने के परिणामस्वरूप अधिक दूर के कार्बन परमाणुओं के बीच की दूरी (कुछ सीमाओं के भीतर) बदल सकती है। यह घूर्णन एस-बॉन्ड बनाने वाले ऑर्बिटल्स के ओवरलैप को बाधित नहीं करता है, क्योंकि इस बॉन्ड में अक्षीय समरूपता है।


एस-आबंध के चारों ओर परमाणुओं के समूहों के घूमने से बनने वाले एक अणु के विभिन्न स्थानिक रूपों को कहा जाता है रचना(चित्र 31)।
संरचनाएं ऊर्जा में भिन्न होती हैं, लेकिन यह अंतर छोटा (12-15 kJ/mol) होता है। अल्केन्स की रचनाएँ जिनमें परमाणु यथासंभव दूर स्थित होते हैं, अधिक स्थिर होते हैं (इलेक्ट्रॉन कोश का प्रतिकर्षण)। तापीय गति की ऊर्जा के कारण एक संरचना से दूसरी संरचना में संक्रमण होता है। संरचना को चित्रित करने के लिए, विशेष स्थानिक सूत्रों (न्यूमैन के सूत्र) का उपयोग किया जाता है।
भ्रमित मत होइए!
संरचना और विन्यास की अवधारणाओं के बीच अंतर करना आवश्यक है।
विभिन्न संरचनाएँ रासायनिक बंधनों को तोड़े बिना एक-दूसरे में परिवर्तित हो सकती हैं। एक विन्यास वाले अणु को दूसरे विन्यास वाले अणु में बदलने के लिए रासायनिक बंधनों को तोड़ने की आवश्यकता होती है।
चार प्रकार का संवयविताअल्केन्स की दो विशेषताएँ हैं: कार्बन कंकाल का समावयवता और ऑप्टिकल समावयवता (भाग देखें)।
अल्केन्स में रासायनिक बंधन, उनका टूटना और बनना अल्केन्स के रासायनिक गुणों को निर्धारित करता है। सी-सी और सी-एच बांड सहसंयोजक, सरल (एस-बॉन्ड), व्यावहारिक रूप से गैर-ध्रुवीय, काफी मजबूत हैं, इसलिए:
1) अल्केन्स अक्सर ऐसी प्रतिक्रियाओं में प्रवेश करते हैं जिनमें बंधों के हेमोलिटिक दरार शामिल होते हैं;
2) अन्य वर्गों के कार्बनिक यौगिकों की तुलना में, अल्केन्स की प्रतिक्रियाशीलता कम होती है (इसके लिए उन्हें कहा जाता है)। पैराफिन- "गुणों से रहित")। इस प्रकार, उबालने पर भी अल्केन्स एसिड, क्षार और ऑक्सीकरण एजेंटों (उदाहरण के लिए, पोटेशियम परमैंगनेट) के जलीय घोल की क्रिया के प्रति प्रतिरोधी होते हैं।
अल्केन्स अपने साथ अन्य अणु जुड़ने पर प्रतिक्रिया नहीं करते, क्योंकि अल्केन्स के अणुओं में एकाधिक बंधन नहीं होते हैं।
प्लैटिनम या निकल के रूप में उत्प्रेरक की उपस्थिति में मजबूत हीटिंग के तहत अल्केन्स का विघटन होता है, और अल्केन्स से हाइड्रोजन समाप्त हो जाता है।
अल्केन्स आइसोमेराइजेशन प्रतिक्रियाओं से गुजर सकते हैं। उनकी विशिष्ट प्रतिक्रिया है प्रतिस्थापन प्रतिक्रिया,एक कट्टरपंथी तंत्र के माध्यम से आगे बढ़ना।
रासायनिक गुण
कट्टरपंथी विस्थापन प्रतिक्रियाएं
उदाहरण के तौर पर विचार करें हैलोजन के साथ अल्केन्स की परस्पर क्रिया।फ्लोरीन बहुत तीव्रता से प्रतिक्रिया करता है (आमतौर पर विस्फोट के साथ) - इस मामले में, सभी सी-एच और सी-सी बंधन टूट जाते हैं, और परिणामस्वरूप, सीएफ 4 और एचएफ यौगिक बनते हैं। प्रतिक्रिया का कोई व्यावहारिक महत्व नहीं है. आयोडीन अल्केन्स के साथ परस्पर क्रिया नहीं करता है। क्लोरीन या ब्रोमीन के साथ प्रतिक्रियाएँ या तो प्रकाश के साथ या तेज़ गर्मी के साथ होती हैं; इस मामले में, मोनो- से पॉलीहैलोजन-प्रतिस्थापित अल्केन्स का निर्माण होता है, उदाहरण के लिए:
सीएच 3 -सीएच 3 +सीएल 2 ® एचवी सीएच 3 -सीएच 2 -सीएल+एचसीएल
मीथेन हैलोजन डेरिवेटिव का निर्माण एक श्रृंखला के माध्यम से होता है कट्टरपंथी मुक्ततंत्र। प्रकाश के प्रभाव में, क्लोरीन अणु अकार्बनिक रेडिकल में टूट जाते हैं:
अकार्बनिक रेडिकल सीएल. मीथेन अणु से एक इलेक्ट्रॉन के साथ एक हाइड्रोजन परमाणु को अलग करता है, जिससे HC1 और मुक्त रेडिकल CH3 बनता है
![]()
मुक्त रेडिकल सीएल 2 क्लोरीन अणु के साथ परस्पर क्रिया करता है, जिससे हैलोजन व्युत्पन्न और क्लोरीन रेडिकल बनता है।
![]()
ऑक्सीकरण प्रतिक्रिया एक ऑक्सीजन अणु (जो एक डायरेडिकल है) द्वारा हाइड्रोजन परमाणु के अवशोषण से शुरू होती है और फिर एक शाखित श्रृंखला प्रतिक्रिया के रूप में आगे बढ़ती है। प्रतिक्रिया के दौरान रेडिकल्स की संख्या बढ़ जाती है। प्रक्रिया साथ है
बड़ी मात्रा में ऊष्मा छोड़ने से न केवल सी-एच बांड, बल्कि सी-सी बांड भी टूट जाते हैं, जिसके परिणामस्वरूप कार्बन मोनोऑक्साइड (IV) और पानी बनता है। प्रतिक्रिया दहन के रूप में आगे बढ़ सकती है या विस्फोट का कारण बन सकती है।
2С n Н2 n+2 +(3n+1)О 2 ®2nСО 2 +(2n+2)Н 2 O
सामान्य तापमान पर, ऑक्सीकरण प्रतिक्रिया नहीं होती है; इसे या तो प्रज्वलन या विद्युत निर्वहन द्वारा शुरू किया जा सकता है।
तेज़ ताप (1000°C से अधिक) के साथ, अल्केन्स पूरी तरह से कार्बन और हाइड्रोजन में विघटित हो जाते हैं। इस प्रतिक्रिया को कहा जाता है पायरोलिसिस।
सीएच 4 ® 1200° सी+2एच 2
विभिन्न उत्प्रेरकों की उपस्थिति में वायुमंडलीय ऑक्सीजन के साथ अल्केन्स, विशेष रूप से मीथेन के हल्के ऑक्सीकरण से, मिथाइल अल्कोहल, फॉर्मेल्डिहाइड और फॉर्मिक एसिड प्राप्त किया जा सकता है।

यदि मीथेन को किसी गर्म क्षेत्र से बहुत तेजी से गुजारा जाए और फिर तुरंत पानी से ठंडा किया जाए, तो परिणाम एसिटिलीन होता है।
यह प्रतिक्रिया औद्योगिक संश्लेषण का आधार है जिसे कहा जाता है खुरमीथेन का (अपूर्ण अपघटन)।
मीथेन होमोलॉग्स की क्रैकिंग कम तापमान (लगभग 600 डिग्री सेल्सियस) पर की जाती है। उदाहरण के लिए, प्रोपेन क्रैकिंग में निम्नलिखित चरण शामिल हैं:

तो, अल्केन्स के टूटने से कम आणविक भार वाले अल्केन्स और अल्केन्स का मिश्रण बनता है।
उत्प्रेरक (पीटी या नी) की उपस्थिति में अल्केन्स को 300-350 डिग्री सेल्सियस (क्रैकिंग अभी तक नहीं हुई है) तक गर्म करने से होता है निर्जलीकरण- हाइड्रोजन को हटाना.

जब पतला नाइट्रिक एसिड 140°C और निम्न दबाव पर अल्केन्स पर कार्य करता है, तो एक कट्टरपंथी प्रतिक्रिया होती है:
सीएच 3 -सीएच 3 + एचएनओ 3 ®सीएच 3 -सीएच 2 -एनओ 2 + एच 2 ओ आइसोमराइज़ेशन
कुछ शर्तों के तहत, सामान्य अल्केन्स शाखित-श्रृंखला अल्केन्स में बदल सकते हैं।
अल्केन्स की तैयारी
आइए मीथेन उत्पादन के उदाहरण का उपयोग करके अल्केन्स के उत्पादन पर विचार करें। मीथेन प्रकृति में व्यापक है। यह कई ज्वलनशील गैसों का मुख्य घटक है, दोनों प्राकृतिक (90-98%) और कृत्रिम, जो लकड़ी, पीट, कोयले के सूखे आसवन के साथ-साथ तेल के टूटने के दौरान निकलती हैं। प्राकृतिक गैसों, विशेष रूप से तेल क्षेत्रों से जुड़ी गैसों में मीथेन के अलावा ईथेन, प्रोपेन, ब्यूटेन और पेंटेन होते हैं।
मीथेन को दलदलों के नीचे से और खदानों में कोयले की परतों से छोड़ा जाता है, जहां यह हवा तक पहुंच के बिना पौधों के मलबे के धीमी गति से अपघटन के दौरान बनता है। इसलिए, मीथेन को अक्सर दलदली गैस या फ़ायरडैम्प कहा जाता है।
प्रयोगशाला में, सोडियम एसीटेट और सोडियम हाइड्रॉक्साइड के मिश्रण को गर्म करके मीथेन का उत्पादन किया जाता है:
CH 3 COONa+NaOH® 200 ° Na 2 CO 3 +CH 4
या जब एल्यूमीनियम कार्बाइड पानी के साथ परस्पर क्रिया करता है: Al 4 Cl 3 +12H 2 O®4Al(OH) 3 +3CH 4
बाद के मामले में, मीथेन बहुत शुद्ध हो जाता है।
उत्प्रेरक की उपस्थिति में गर्म करके साधारण पदार्थों से मीथेन का उत्पादन किया जा सकता है:
सी+2एच 2 ® नी सीएच 4 8 भी जल गैस पर आधारित संश्लेषण द्वारा
CO+3H 2 ® Ni CH 4 +H 2 O
यह विधि औद्योगिक महत्व की है। हालाँकि, कोयले की कोकिंग और तेल शोधन के दौरान बनने वाली प्राकृतिक गैसों या गैसों से मीथेन का आमतौर पर उपयोग किया जाता है।
मीथेन की तरह, मीथेन के समरूप, क्षार के साथ संबंधित कार्बनिक अम्लों के लवणों के कैल्सीनेशन द्वारा प्रयोगशाला स्थितियों में प्राप्त किए जाते हैं। एक अन्य विधि वुर्ट्ज़ प्रतिक्रिया है, अर्थात। उदाहरण के लिए, मोनोहैलोजन डेरिवेटिव को सोडियम धातु के साथ गर्म करना:
C 2 H 5 Br+2Na+BrC 2 H 6 ® C 2 H 5 -C 2 H 5 +2NaBr
प्रौद्योगिकी में, संश्लेषण का उपयोग तकनीकी गैसोलीन (6-10 कार्बन परमाणुओं वाले हाइड्रोकार्बन का मिश्रण) का उत्पादन करने के लिए किया जाता है।
उत्प्रेरक (कोबाल्ट यौगिक) की उपस्थिति में और ऊंचे दबाव पर कार्बन मोनोऑक्साइड (II) और हाइड्रोजन से। प्रक्रिया
समीकरण द्वारा व्यक्त किया जा सकता है
nСО+(2n+1)Н 2 ® 200° C n H 2n+2 +nН 2 O
तो, अल्केन्स के मुख्य स्रोत प्राकृतिक गैस और तेल हैं। हालाँकि, कुछ संतृप्त हाइड्रोकार्बन अन्य यौगिकों से संश्लेषित होते हैं।
अल्केन्स के अनुप्रयोग
अधिकांश अल्केन्स का उपयोग ईंधन के रूप में किया जाता है। क्रैकिंग और
उनके डिहाइड्रोजनीकरण से असंतृप्त हाइड्रोकार्बन बनते हैं, जो
जिससे कई अन्य कार्बनिक पदार्थ प्राप्त होते हैं।
मीथेन प्राकृतिक गैसों का मुख्य भाग (60-99%) है। भाग
प्राकृतिक गैसों में प्रोपेन और ब्यूटेन शामिल हैं। तरल हाइड्रोकार्बन
आंतरिक दहन इंजन, कार, हवाई जहाज आदि में ईंधन के रूप में उपयोग किया जाता है। तरल का एक शुद्ध मिश्रण
और ठोस अल्केन्स वैसलीन बनाते हैं। उच्चतर अल्केन्स हैं
सिंथेटिक डिटर्जेंट के उत्पादन के लिए प्रारंभिक सामग्री। आइसोमेराइजेशन द्वारा प्राप्त अल्केन्स का उपयोग उच्च गुणवत्ता वाले गैसोलीन और रबर के उत्पादन में किया जाता है। नीचे मीथेन के उपयोग का एक चित्र है

साइक्लोऐल्केन
संरचना
साइक्लोअल्केन्स संतृप्त हाइड्रोकार्बन हैं जिनके अणुओं में कार्बन परमाणुओं की एक बंद अंगूठी होती है।
साइक्लोऐल्केन (साइक्लोपैराफिन्स) सामान्य सूत्र C n H 2 n के साथ एक समजात श्रृंखला बनाते हैं, जिसमें पहला सदस्य होता है
साइक्लोप्रोपेन सी 3 एच 6, क्योंकि एक वलय बनाने के लिए कम से कम तीन कार्बन परमाणु मौजूद होने चाहिए।
साइक्लोअल्केन्स के कई नाम हैं: साइक्लोपेराफिन्स, नेफ्थेनेस, साइक्लेन, पॉलीमेथिलीन। कुछ कनेक्शनों के उदाहरण:

सूत्र C n H 2 n साइक्लोपैराफिन्स की विशेषता है, और बिल्कुल वही सूत्र एल्केन्स की समजात श्रृंखला (एक एकाधिक बंधन वाले असंतृप्त हाइड्रोकार्बन) का वर्णन करता है। इससे हम यह निष्कर्ष निकाल सकते हैं कि प्रत्येक साइक्लोअल्केन एक संगत एल्कीन के साथ आइसोमेरिक है - यह "इंटरक्लास" आइसोमेरिज्म का एक उदाहरण है।
रिंग आकार के आधार पर साइक्लोअल्केन्स को कई समूहों में विभाजित किया गया है, जिनमें से हम दो पर विचार करेंगे: छोटे (सी 3, सी 4) और साधारण (सी 5 -सी 7) चक्र।
साइक्लोअल्केन्स के नाम का निर्माण एल्केन के नाम में कार्बन परमाणुओं की संगत संख्या के साथ उपसर्ग साइक्लो- जोड़कर किया जाता है। चक्र में क्रमांकन इस प्रकार किया जाता है कि प्रतिस्थापकों को न्यूनतम संख्याएँ प्राप्त हों।
साइक्लोअल्केन्स के संरचनात्मक सूत्र आमतौर पर संक्षिप्त रूप में लिखे जाते हैं, जिसमें रिंग के ज्यामितीय आकार का उपयोग किया जाता है और कार्बन और हाइड्रोजन परमाणुओं के प्रतीकों को छोड़ दिया जाता है। उदाहरण के लिए:

साइक्लोअल्केन्स की संरचनात्मक आइसोमेरिज्म रिंग के आकार (साइक्लोबुटेन और मिथाइलसाइक्लोप्रोपेन आइसोमर्स हैं) और रिंग में प्रतिस्थापन की स्थिति (उदाहरण के लिए, 1,1- और 1,2-डाइमिथाइलब्यूटेन) के साथ-साथ उनकी संरचना से निर्धारित होती है। .
स्थानिक समावयवता भी साइक्लोअल्केन्स की विशेषता है, क्योंकि यह वलय तल के सापेक्ष प्रतिस्थापकों की विभिन्न व्यवस्थाओं से जुड़ा है। जब प्रतिस्थापकों को रिंग तल के एक तरफ रखा जाता है, तो सीआईएस-आइसोमर्स प्राप्त होते हैं, और ट्रांस-आइसोमर्स विपरीत पक्षों पर प्राप्त होते हैं।
संतृप्त हाइड्रोकार्बन- ये हाइड्रोकार्बन हैं जिनके अणुओं में केवल सरल (एकल) बंधन (-बंध) होते हैं। संतृप्त हाइड्रोकार्बन अल्केन्स और साइक्लोअल्केन्स हैं।
संतृप्त हाइड्रोकार्बन में कार्बन परमाणु एसपी 3 संकरण की स्थिति में हैं।
हाइड्रोकार्बन- संतृप्त हाइड्रोकार्बन, जिसकी संरचना सामान्य सूत्र सी द्वारा व्यक्त की जाती है एनएच 2एन+2. अल्केन्स संतृप्त हाइड्रोकार्बन हैं।
आइसोमर्स और होमोलॉग्स
| जी | सीएच 4 मीथेन |
||||
| सीएच 3 -सीएच 3 एटैन |
|||||
| सीएच 3 -सीएच 2 -सीएच 3 प्रोपेन |
|||||
| सीएच 3—(सीएच 2) 2—सीएच 3 बुटान |
2-मिथाइलप्रोपेन |
||||
| सीएच 3—(सीएच 2) 3—सीएच 3 पेंटेन |
2-मिथाइलब्यूटेन |
2,2-डाइमिथाइलप्रोपेन |
|||
| सीएच 3—(सीएच 2) 4—सीएच 3 हेक्सेन |
2-मिथाइलपेंटेन |
2,2-डाइमिथाइलब्यूटेन |
2,3-डाइमिथाइलब्यूटेन |
3-मिथाइलपेंटेन |
|
| आइसोमरों | |||||
अल्केन्स के भौतिक गुण
कमरे के तापमान पर, C 1-C 4 गैसें हैं, C 5-C 15 तरल पदार्थ हैं, C 16 और निम्नलिखित ठोस हैं; पानी में अघुलनशील; घनत्व 1 ग्राम/सेमी3 से कम; तरल - गैसोलीन की गंध के साथ।
जैसे-जैसे किसी अणु में कार्बन परमाणुओं की संख्या बढ़ती है, क्वथनांक बढ़ता है।
अल्केन्स के रासायनिक गुण
सामान्य परिस्थितियों में कम गतिविधि, अम्ल और क्षार के घोल के साथ प्रतिक्रिया न करें, KMnO4 घोल और ब्रोमीन पानी का रंग फीका न करें।
>अल्केन्स की तैयारी
>>साइक्लोऐल्केन- संतृप्त हाइड्रोकार्बन, जिसकी संरचना सूत्र सी द्वारा व्यक्त की जाती है एनएच 2 एन. साइक्लोअल्केन अणुओं में बंद कार्बन श्रृंखलाएं (चक्र) होती हैं।
आइसोमर्स और होमोलॉग्स
| जी | साइक्लोप्रोपेन सी 3 एच 6 या |
||||
| साइक्लोब्यूटेन C4H8 या |
मिथाइलसाइक्लोप्रोपेन |
||||
| साइक्लोपेंटेन सी 5 एच 10 या |
मिथाइलसाइक्लोब्यूटेन |
1,1-डाइमिथाइलसाइक्लोप्रोपेन |
1,2-डाइमिथाइलसाइक्लोप्रोपेन |
इथाइलसाइक्लोप्रोपेन |
|
| आइसोमरों | |||||
सरलीकृत रूप से, हाइड्रोकार्बन चक्र को अक्सर उचित संख्या में कोणों के साथ एक नियमित बहुभुज के रूप में दर्शाया जाता है।
भौतिक गुण अल्केन्स से बहुत कम भिन्न होते हैं।
रासायनिक गुण
साइक्लोप्रोपेन और साइक्लोब्यूटेन के अपवाद के साथ, अल्केन्स की तरह, साइक्लोअल्केन्स सामान्य परिस्थितियों में निष्क्रिय होते हैं।
साइक्लोअल्केन्स के सामान्य गुण (उदाहरण के तौर पर साइक्लोहेक्सेन का उपयोग करके):
>साइक्लोप्रोपेन और साइक्लोब्यूटेन के विशेष गुण (अतिरिक्त प्रतिक्रियाओं की प्रवृत्ति):
साइक्लोअल्केन्स प्राप्त करने की विधियाँ
संतृप्त हाइड्रोकार्बन के नाम संकलित करने के लिए एल्गोरिदम
- कार्बन बैकबोन खोजें: यह कार्बन परमाणुओं की सबसे लंबी श्रृंखला है।
- मुख्य श्रृंखला में कार्बन परमाणुओं को शाखा के निकटतम सिरे से शुरू करके क्रमांकित करें।
- मुख्य श्रृंखला में उस कार्बन परमाणु की संख्या इंगित करें जिसमें एक प्रतिस्थापी है और प्रतिस्थापी का नाम दें। यदि कई स्थानापन्न हैं, तो उन्हें वर्णानुक्रम में व्यवस्थित करें। समान प्रतिस्थापकों के नाम से पहले, उन सभी कार्बन परमाणुओं की संख्या इंगित करें जिनसे वे बंधे हैं और गुणन उपसर्गों (di-, tri-, tetra-) का उपयोग करें।
- प्रत्यय -an के साथ मुख्य श्रृंखला का नाम लिखें। मुख्य श्रृंखला के नामों की जड़ें: सी 1 - मेट, सी 2 - एट, सी 3 - प्रोप, सी 4 - लेकिन, सी 5 - पेंट, सी 6 - हेक्स, सी 7 - हेप, सी 8 - ओकेटी, सी 9 - गैर, 10 - दिसंबर से। अप्रतिस्थापित साइक्लोअल्केन्स के नाम संतृप्त हाइड्रोकार्बन के नाम से उपसर्ग साइक्लो- के योग से बनते हैं। यदि साइक्लोअल्केन में प्रतिस्थापी हैं, तो वलय में कार्बन परमाणुओं को सबसे सरल प्रतिस्थापी (सबसे पुराना, मिथाइल) से लेकर अधिक जटिल तक सबसे कम तरीके से क्रमांकित किया जाता है, और प्रतिस्थापकों की स्थिति को उसी तरह दर्शाया जाता है जैसे कि अल्केन्स।
"विषय 1. "संतृप्त हाइड्रोकार्बन" विषय पर कार्य और परीक्षण।"
- हाइड्रोकार्बन। पॉलिमर - कार्बनिक पदार्थ ग्रेड 8-9
पाठ: 7 कार्य: 9 परीक्षण: 1
- - पदार्थों, सामग्रियों और रासायनिक प्रतिक्रियाओं की दुनिया में मनुष्य, ग्रेड 8-9
पाठ: 2 असाइनमेंट: 6 परीक्षण: 1
- पदार्थों का वर्गीकरण - अकार्बनिक पदार्थों के वर्ग ग्रेड 8-9
पाठ: 2 असाइनमेंट: 9 परीक्षण: 1
एक।प्रतिक्रिया में भाग लेने वाले एक पदार्थ की विशेषताओं (द्रव्यमान, आयतन, पदार्थ की मात्रा) को देखते हुए, आपको दूसरे पदार्थ की विशेषताओं को खोजने की आवश्यकता है।उदाहरण। 11.2 लीटर मीथेन के प्रथम चरण के क्लोरीनीकरण के लिए आवश्यक क्लोरीन का द्रव्यमान निर्धारित करें।
उत्तर: एम(सीएल 2) = 35.5 ग्राम।
बी।गैसों के आयतन अनुपात के नियम का उपयोग करके गणना।
उदाहरण।निर्धारित करें कि प्रोपेन (एन.ओ.) के 10 मीटर 3 के पूर्ण दहन के लिए सामान्य परिस्थितियों (एन.ओ.) के तहत मापी गई ऑक्सीजन की कितनी मात्रा की आवश्यकता होगी।
उत्तर: वी(ओ 2) = 50 मीटर 3।यह सुनिश्चित करने के बाद कि आपको जो कुछ भी चाहिए वह पूरा हो गया है, विषय 1 के कार्यों को पूरा करने के लिए आगे बढ़ें। हम आपकी सफलता की कामना करते हैं।
अनुशंसित पाठ:- ओ. एस. गेब्रियलियन और अन्य। रसायन विज्ञान 10वीं कक्षा। एम., बस्टर्ड, 2002;
- एल. एस. गुज़े, आर. पी. सुरोवत्सेवा, जी. जी. लिसोवा। रसायन शास्त्र 11वीं कक्षा। बस्टर्ड, 1999.
- जी जी लिसोवा। कार्बनिक रसायन विज्ञान में बुनियादी नोट्स और परीक्षण। एम., ग्लिक प्लस एलएलसी, 1999।
संतृप्त हाइड्रोकार्बन ऐसे यौगिक होते हैं जो एसपी 3 संकरण की स्थिति में कार्बन परमाणुओं से युक्त अणु होते हैं। वे विशेष रूप से सहसंयोजक सिग्मा बांड द्वारा एक दूसरे से जुड़े हुए हैं। "संतृप्त" या "संतृप्त" हाइड्रोकार्बन नाम इस तथ्य से आता है कि इन यौगिकों में किसी भी परमाणु को जोड़ने की क्षमता नहीं होती है। वे चरम पर हैं, पूरी तरह से संतृप्त हैं। इसका अपवाद साइक्लोअल्केन्स है।
अल्केन्स क्या हैं?
अल्केन्स संतृप्त हाइड्रोकार्बन हैं, और उनकी कार्बन श्रृंखला खुली होती है और इसमें कार्बन परमाणु एकल बांड का उपयोग करके एक दूसरे से जुड़े होते हैं। इसमें अन्य (अर्थात, एल्केन्स की तरह डबल, या एल्काइल्स की तरह ट्रिपल) बंधन शामिल नहीं हैं। अल्केन्स को पैराफिन भी कहा जाता है। उन्हें यह नाम इसलिए मिला क्योंकि प्रसिद्ध पैराफिन मुख्य रूप से विशेष निष्क्रियता वाले इन संतृप्त हाइड्रोकार्बन सी 18-सी 35 का मिश्रण हैं।
अल्केन्स और उनके रेडिकल्स के बारे में सामान्य जानकारी
उनका सूत्र: सी एन पी 2 एन +2, यहां एन 1 से बड़ा या उसके बराबर है। दाढ़ द्रव्यमान की गणना सूत्र का उपयोग करके की जाती है: एम = 14 एन + 2। विशेषता विशेषता: उनके नामों में अंत "-एएन" हैं। उनके अणुओं के अवशेष, जो हाइड्रोजन परमाणुओं के अन्य परमाणुओं के साथ प्रतिस्थापन के परिणामस्वरूप बनते हैं, एलिफैटिक रेडिकल या एल्काइल कहलाते हैं। उन्हें अक्षर आर द्वारा नामित किया गया है। मोनोवैलेंट एलिफैटिक रेडिकल्स का सामान्य सूत्र: सी एन पी 2 एन +1, यहां एन 1 से अधिक या उसके बराबर है। एलिफैटिक रेडिकल्स के दाढ़ द्रव्यमान की गणना सूत्र द्वारा की जाती है: एम = 14 एन + 1. स्निग्ध मूलकों की एक विशिष्ट विशेषता: नामों में अंत "- गाद।" अल्केन अणुओं की अपनी संरचनात्मक विशेषताएं होती हैं:
- सी-सी बांड की विशेषता 0.154 एनएम की लंबाई है;
- सी-एच बांड की विशेषता 0.109 एनएम की लंबाई है;
- बांड कोण (कार्बन-कार्बन बांड के बीच का कोण) 109 डिग्री और 28 मिनट है।

अल्केन्स सजातीय श्रृंखला शुरू करते हैं: मीथेन, ईथेन, प्रोपेन, ब्यूटेन, इत्यादि।
अल्केन्स के भौतिक गुण
अल्केन्स ऐसे पदार्थ हैं जो रंगहीन और पानी में अघुलनशील होते हैं। जिस तापमान पर अल्केन्स पिघलना शुरू करते हैं और जिस तापमान पर वे उबलते हैं वह आणविक भार और हाइड्रोकार्बन श्रृंखला की लंबाई में वृद्धि के अनुसार बढ़ता है। कम शाखायुक्त से अधिक शाखायुक्त अल्केन्स की ओर, क्वथनांक और गलनांक कम हो जाते हैं। गैसीय अल्केन्स हल्की नीली या रंगहीन लौ के साथ जल सकते हैं और काफी अधिक गर्मी पैदा कर सकते हैं। सीएच 4 -सी 4 एच 10 ऐसी गैसें हैं जिनमें कोई गंध नहीं होती है। सी 5 एच 12 -सी 15 एच 32 ऐसे तरल पदार्थ हैं जिनकी एक विशिष्ट गंध होती है। सी 15 एच 32 इत्यादि ऐसे ठोस पदार्थ हैं जो गंधहीन भी होते हैं।
अल्केन्स के रासायनिक गुण
ये यौगिक रासायनिक रूप से निष्क्रिय हैं, जिन्हें मुश्किल से टूटने वाले सिग्मा बांड - सी-सी और सी-एच की ताकत से समझाया जा सकता है। यह भी विचार करने योग्य है कि सी-सी बांड गैर-ध्रुवीय हैं, और सी-एच बांड कम-ध्रुवीय हैं। ये सिग्मा प्रकार से संबंधित निम्न-ध्रुवीकृत प्रकार के बंधन हैं और, तदनुसार, होमोलिटिक तंत्र द्वारा इनके टूटने की सबसे अधिक संभावना है, जिसके परिणामस्वरूप रेडिकल बनेंगे। इस प्रकार, अल्केन्स के रासायनिक गुण मुख्य रूप से कट्टरपंथी प्रतिस्थापन प्रतिक्रियाओं तक सीमित हैं।

नाइट्रेशन प्रतिक्रियाएँ
अल्केन्स केवल 10% की सांद्रता वाले नाइट्रिक एसिड के साथ या 140 डिग्री सेल्सियस के तापमान पर गैसीय वातावरण में टेट्रावेलेंट नाइट्रोजन ऑक्साइड के साथ प्रतिक्रिया करते हैं। अल्केन्स की नाइट्रेशन प्रतिक्रिया को कोनोवलोव प्रतिक्रिया कहा जाता है। परिणामस्वरूप, नाइट्रो यौगिक और पानी बनते हैं: सीएच 4 + नाइट्रिक एसिड (पतला) = सीएच 3 - एनओ 2 (नाइट्रोमेथेन) + पानी।
दहन प्रतिक्रियाएँ
संतृप्त हाइड्रोकार्बन का उपयोग अक्सर ईंधन के रूप में किया जाता है, जो उनकी जलने की क्षमता से उचित है: C n P 2n+2 + ((3n+1)/2) O 2 = (n+1) H 2 O + n CO 2।
ऑक्सीकरण प्रतिक्रियाएँ
अल्केन्स के रासायनिक गुणों में उनकी ऑक्सीकरण करने की क्षमता भी शामिल है। प्रतिक्रिया के साथ कौन सी स्थितियाँ आती हैं और वे कैसे बदलती हैं, इसके आधार पर, एक ही पदार्थ से अलग-अलग अंतिम उत्पाद प्राप्त किए जा सकते हैं। प्रतिक्रिया को तेज करने वाले उत्प्रेरक की उपस्थिति में ऑक्सीजन के साथ मीथेन के हल्के ऑक्सीकरण और लगभग 200 डिग्री सेल्सियस के तापमान के परिणामस्वरूप निम्नलिखित पदार्थ हो सकते हैं:
1) 2सीएच 4 (ऑक्सीजन के साथ ऑक्सीकरण) = 2सीएच 3 ओएच (अल्कोहल - मेथनॉल)।
2) सीएच 4 (ऑक्सीजन के साथ ऑक्सीकरण) = सीएच 2 ओ (एल्डिहाइड - मिथेनल या फॉर्मेल्डिहाइड) + एच 2 ओ।
3) 2CH 4 (ऑक्सीजन के साथ ऑक्सीकरण) = 2HCOOH (कार्बोक्जिलिक एसिड - मीथेन या फॉर्मिक) + 2H 2 O।

इसके अलावा, अल्केन्स का ऑक्सीकरण हवा के साथ गैसीय या तरल माध्यम में किया जा सकता है। ऐसी प्रतिक्रियाओं से उच्च वसायुक्त अल्कोहल और संबंधित एसिड का निर्माण होता है।
ताप से संबंध
+150-250 डिग्री सेल्सियस से अधिक नहीं तापमान पर, हमेशा उत्प्रेरक की उपस्थिति में, कार्बनिक पदार्थों की एक संरचनात्मक पुनर्व्यवस्था होती है, जिसमें परमाणुओं के कनेक्शन के क्रम में बदलाव होता है। इस प्रक्रिया को आइसोमेराइजेशन कहा जाता है, और प्रतिक्रिया से उत्पन्न पदार्थों को आइसोमर्स कहा जाता है। इस प्रकार, सामान्य ब्यूटेन से, इसका आइसोमर प्राप्त होता है - आइसोब्यूटेन। 300-600 डिग्री सेल्सियस के तापमान और एक उत्प्रेरक की उपस्थिति पर, सी-एच बांड हाइड्रोजन अणुओं (डीहाइड्रोजनीकरण प्रतिक्रियाओं) के निर्माण के साथ टूट जाते हैं, हाइड्रोजन अणु कार्बन श्रृंखला के एक चक्र में बंद होने के साथ टूट जाते हैं (अल्केन्स का चक्रीकरण या सुगंधीकरण प्रतिक्रियाएं) :
1) 2सीएच 4 = सी 2 एच 4 (एथीन) + 2एच 2।
2) 2सीएच 4 = सी 2 एच 2 (एथिन) + 3एच 2।
3) सी 7 एच 16 (सामान्य हेप्टेन) = सी 6 एच 5 - सीएच 3 (टोल्यूनि) + 4 एच 2।

हैलोजनीकरण प्रतिक्रियाएँ
ऐसी प्रतिक्रियाओं में कार्बनिक पदार्थ के अणु में हैलोजन (उनके परमाणु) का परिचय शामिल होता है, जिसके परिणामस्वरूप सी-हैलोजन बंधन बनता है। जब अल्केन्स हैलोजन के साथ प्रतिक्रिया करते हैं, तो हैलोजन व्युत्पन्न बनते हैं। इस प्रतिक्रिया की विशिष्ट विशेषताएं हैं। यह एक कट्टरपंथी तंत्र के अनुसार आगे बढ़ता है, और इसे आरंभ करने के लिए, हैलोजन और अल्केन्स के मिश्रण को पराबैंगनी विकिरण के संपर्क में लाना या बस इसे गर्म करना आवश्यक है। अल्केन्स के गुण हैलोजन परमाणुओं के साथ पूर्ण प्रतिस्थापन प्राप्त होने तक हैलोजनीकरण प्रतिक्रिया को आगे बढ़ने की अनुमति देते हैं। यानी मीथेन का क्लोरीनीकरण और मिथाइल क्लोराइड का उत्पादन एक चरण में समाप्त नहीं होगा। प्रतिक्रिया आगे बढ़ेगी, सभी संभावित प्रतिस्थापन उत्पाद बनेंगे, क्लोरोमेथेन से शुरू होकर कार्बन टेट्राक्लोराइड तक। इन परिस्थितियों में अन्य अल्केन्स के क्लोरीन के संपर्क में आने से विभिन्न कार्बन परमाणुओं में हाइड्रोजन के प्रतिस्थापन के परिणामस्वरूप विभिन्न उत्पादों का निर्माण होगा। जिस तापमान पर प्रतिक्रिया होती है वह अंतिम उत्पादों का अनुपात और उनके गठन की दर निर्धारित करेगा। एल्केन की हाइड्रोकार्बन श्रृंखला जितनी लंबी होगी, प्रतिक्रिया उतनी ही आसान होगी। हैलोजनीकरण के दौरान सबसे पहले सबसे कम हाइड्रोजनीकृत (तृतीयक) कार्बन परमाणु को प्रतिस्थापित किया जाएगा। प्राथमिक व्यक्ति अन्य सभी के बाद प्रतिक्रिया करेगा। हैलोजनीकरण प्रतिक्रिया चरणों में होगी। पहले चरण में, केवल एक हाइड्रोजन परमाणु को प्रतिस्थापित किया जाता है। अल्केन्स हैलोजन समाधान (क्लोरीन और ब्रोमीन पानी) के साथ परस्पर क्रिया नहीं करते हैं।

सल्फ़ोक्लोरिनेशन प्रतिक्रियाएँ
अल्केन्स के रासायनिक गुणों को सल्फोक्लोरिनेशन प्रतिक्रिया (रीड प्रतिक्रिया कहा जाता है) द्वारा भी पूरक किया जाता है। पराबैंगनी विकिरण के संपर्क में आने पर, अल्केन्स क्लोरीन और सल्फर डाइऑक्साइड के मिश्रण के साथ प्रतिक्रिया करने में सक्षम होते हैं। परिणामस्वरूप, हाइड्रोजन क्लोराइड बनता है, साथ ही एक एल्काइल रेडिकल भी बनता है, जो सल्फर डाइऑक्साइड जोड़ता है। परिणाम एक जटिल यौगिक है जो क्लोरीन परमाणु के कब्जे और उसके अगले अणु के विनाश के कारण स्थिर हो जाता है: आर-एच + एसओ 2 + सीएल 2 + पराबैंगनी विकिरण = आर-एसओ 2 सीएल + एचसीएल। प्रतिक्रिया के परिणामस्वरूप बनने वाले सल्फोनील क्लोराइड का व्यापक रूप से सर्फेक्टेंट के उत्पादन में उपयोग किया जाता है।
एल्केन्स पेट्रोलियम उत्पादों, प्राकृतिक गैस और कोयले से प्राप्त होते हैं। अल्केन्स का मुख्य उपयोग ईंधन के रूप में होता है। पदार्थों का उपयोग सॉल्वैंट्स, सौंदर्य प्रसाधन और डामर बनाने के लिए भी किया जाता है।
विवरण
अल्केन्स संतृप्त या संतृप्त हाइड्रोकार्बन का एक वर्ग है। इसका मतलब यह है कि एल्केन अणुओं में हाइड्रोजन परमाणुओं की अधिकतम संख्या होती है। अल्केन्स की सजातीय श्रृंखला के यौगिकों का सामान्य सूत्र C n H 2n+2 है। पदार्थों के नाम ग्रीक अंकों और प्रत्यय -an से बने होते हैं।
अल्केन्स के भौतिक और रासायनिक गुण उनकी संरचना पर निर्भर करते हैं। जैसे-जैसे किसी अणु में कार्बन परमाणुओं की संख्या बढ़ती है, गैसीय पदार्थों से ठोस यौगिकों में संक्रमण होता है।
कार्बन परमाणुओं की संख्या के आधार पर अल्केन्स की भौतिक स्थिति:
- सी 1 -सी 4- गैसें;
- 5 से 15 तक- तरल पदार्थ;
- 16 से - 390 से- ठोस.
गैसें नीली लौ के साथ जलती हैं, जिससे बड़ी मात्रा में गर्मी निकलती है। 18-35 कार्बन परमाणुओं वाले अल्केन्स मोमी, मुलायम पदार्थ होते हैं। इनके मिश्रण से पैराफिन मोमबत्तियाँ बनाई जाती हैं।

चावल। 1. पैराफिन मोमबत्तियाँ।
सजातीय श्रृंखला में आणविक भार बढ़ने के साथ, गलनांक और क्वथनांक बढ़ते हैं।
आवेदन
अल्केन्स को खनिजों - तेल, गैस, कोयले से अलग किया जाता है। प्रसंस्करण के विभिन्न चरणों में, गैसोलीन, मिट्टी का तेल और ईंधन तेल प्राप्त किया जाता है। अल्केन्स का उपयोग चिकित्सा, कॉस्मेटोलॉजी और निर्माण में किया जाता है।

चावल। 2. तेल में तरल अल्केन्स होते हैं।
तालिका संतृप्त हाइड्रोकार्बन के अनुप्रयोग के मुख्य क्षेत्रों का वर्णन करती है।
|
क्षेत्र |
क्या उपयोग किया जाता है |
का उपयोग कैसे करें |
|
ऊर्जा उद्योग |
गैसोलीन, मिट्टी का तेल, ईंधन तेल |
रॉकेट और मोटर ईंधन के रूप में |
|
गैसीय अल्केन्स |
खाना पकाने के लिए घरेलू गैस के रूप में |
|
|
रसायन उद्योग |
पेट्रोलियम ईथर (आइसोपेंटेन और आइसोहेक्सेन का मिश्रण), |
सॉल्वैंट्स, चिकनाई वाले तेल, संसेचन का उत्पादन |
|
पेट्रोलियम जेली (तरल अल्केन्स का मिश्रण), पेट्रोलियम जेली (तरल और ठोस अल्केन्स का मिश्रण), मोमबत्तियाँ, डिटर्जेंट, वार्निश, एनामेल्स, साबुन का उत्पादन। माचिस के लिए संसेचन के रूप में। कार्बनिक अम्लों के उत्पादन में उपयोग करें |
||
|
क्लोरीनयुक्त अल्केन्स |
अल्कोहल, एल्डिहाइड, एसिड का उत्पादन |
|
|
सौंदर्य प्रसाधन |
वैसलीन, पेट्रोलियम जेली |
मलहम का उत्पादन |
|
एरोसोल बनाने के लिए प्रणोदक के रूप में |
||
|
मॉइस्चराइजिंग सौंदर्य प्रसाधनों का उत्पादन |
||
|
निर्माण |
टार (टार) तेल शोधन का अंतिम उत्पाद है, जिसमें अल्केन्स, साइक्लोअल्केन्स, एरेन्स, धातु, गैर-धातुओं का मिश्रण होता है |
डामर सड़कों के उत्पादन के लिए |
|
कागज और लुगदी उद्योग |
पैकेजिंग पेपर के लिए संसेचन के रूप में |
|
|
खाद्य उद्योग |
च्युइंग गम उत्पादन |

चावल। 3. टार.
अल्केन्स का उपयोग रबर, सिंथेटिक कपड़े, प्लास्टिक और सर्फेक्टेंट के निर्माण में किया जाता है। तरलीकृत रूप में प्रोपेन और ब्यूटेन का उपयोग आग बुझाने वाले सिलेंडरों को फिर से भरने के लिए किया जाता है।
हमने क्या सीखा?
हमने अल्केन्स के अनुप्रयोगों के बारे में संक्षेप में सीखा। गैसीय, तरल और ठोस अवस्था में संतृप्त हाइड्रोकार्बन का उपयोग रसायन, भोजन, कागज, ऊर्जा उद्योग, कॉस्मेटोलॉजी और निर्माण में किया जाता है। अल्केन्स का उपयोग सॉल्वैंट्स, पेंट, वार्निश, साबुन, मोमबत्तियाँ, मलहम और डामर के उत्पादन के लिए किया जाता है। तरल अल्केन्स से युक्त गैसोलीन, मिट्टी का तेल और ईंधन तेल का उपयोग ईंधन के रूप में किया जाता है। गैसीय अल्केन्स का उपयोग रोजमर्रा की जिंदगी में और एरोसोल के उत्पादन के लिए किया जाता है। अल्केन्स के मुख्य स्रोत तेल, प्राकृतिक गैस और कोयला हैं।
लेख की सामग्री
अल्केन्स और साइक्लोअल्केन्स- हाइड्रोकार्बन जिसमें सभी कार्बन परमाणु एक दूसरे से और हाइड्रोजन परमाणुओं से सरल (एकल) बंधों द्वारा जुड़े होते हैं। अल्केन्स (समानार्थक शब्द - संतृप्त हाइड्रोकार्बन, संतृप्त हाइड्रोकार्बन, पैराफिन) - सामान्य सूत्र सी वाले हाइड्रोकार्बन एनएच 2 एन+2 , कहाँ एन– कार्बन परमाणुओं की संख्या. परिचित पॉलीथीन का सूत्र एक ही है, केवल आकार एनयह बहुत बड़ा है और हजारों की संख्या में पहुंच सकता है। इसके अलावा, पॉलीथीन में विभिन्न लंबाई के अणु होते हैं। साइक्लोअल्केन्स में, कार्बन परमाणु एक बंद श्रृंखला बनाते हैं; यदि एक चक्र है, तो साइक्लोअल्केन का सूत्र C है एनएच 2 एन .
एक श्रृंखला में कार्बन परमाणुओं के कनेक्शन के क्रम के आधार पर, अल्केन्स को रैखिक और शाखित में विभाजित किया जाता है। तदनुसार, अल्केन्स के लिए एन 4 यह संभव है कि एक ही सूत्र वाले एक से अधिक पदार्थ हों। ऐसे पदार्थों को आइसोमर्स (ग्रीक से) कहा जाता है। आइसिस- बराबर, समान और मेरोस - हिस्सा, भाग।
अल्केन्स के नाम.
शब्द "अल्केन" का मूल शब्द "अल्कोहल" ( नीचे देखें). अप्रचलित शब्द "पैराफिन" लैटिन पैरम से आया है - थोड़ा, नगण्य और एफिनिस - संबंधित; अधिकांश रासायनिक अभिकर्मकों के संबंध में पैराफिन की प्रतिक्रियाशीलता कम होती है। कई पैराफिन समरूप हैं; अल्केन्स की सजातीय श्रृंखला में, प्रत्येक बाद का सदस्य पिछले एक से एक मिथाइलीन समूह सीएच 2 से भिन्न होता है। यह शब्द ग्रीक होमोलोगोस से आया है - संगत, समान।
नामकरण (अक्षांश से। नामपद्धति- नामों की सूची) अल्केन्स के नाम कुछ नियमों के अनुसार बनाए जाते हैं, जो हमेशा स्पष्ट नहीं होते हैं। इसलिए, यदि एक अल्केन अणु में विभिन्न पदार्थ हैं, तो अल्केन के नाम पर उन्हें वर्णमाला क्रम में सूचीबद्ध किया गया है। हालाँकि, यह क्रम अलग-अलग भाषाओं में भिन्न हो सकता है। उदाहरण के लिए, इस नियम के अनुसार हाइड्रोकार्बन CH 3 –CH(CH 3) –CH(C 2 H 5) –CH 2 –CH 2 –CH 3 को रूसी में 2-मिथाइल-3-एथिलहेक्सेन कहा जाएगा, और अंग्रेजी 3-एथिल-2-मिथाइलहेक्सेन…
हाइड्रोकार्बन के नाम के अनुसार, एल्काइल रेडिकल्स को भी कहा जाता है: मिथाइल (सीएच 3 -), एथिल (सी 2 एच 5 -), आइसोप्रोपिल (सीएच 3) 2 सीएच-, मंगल-ब्यूटाइल सी 2 एच 5 –सीएच (सीएच 3)-, आर यू बी-ब्यूटाइल (सीएच 3) 3 सी-, आदि। कई कार्बनिक यौगिकों की संरचना में अल्काइल रेडिकल समग्र रूप से शामिल होते हैं; मुक्त अवस्था में, अयुग्मित इलेक्ट्रॉन वाले ये कण अत्यंत सक्रिय होते हैं।
अल्केन्स के कुछ आइसोमर्स के भी तुच्छ नाम हैं ( सेमी. तुच्छ पदार्थ नाम, जैसे आइसोब्यूटेन (2-मिथाइलप्रोपेन), आइसोक्टेन (2,2,4-ट्राइमेथिलपेंटेन), नियोपेंटेन (2,3-डाइमिथाइलप्रोपेन), स्क्वालेन (2,6,10,15,19,23-हेक्सामेथिलटेट्राकोसेन), जिसका नाम लैटिन से आया है स्क्वैलस- शार्क (स्क्वैलेन का एक असंतृप्त व्युत्पन्न - स्क्वैलिन, चयापचय के लिए महत्वपूर्ण एक यौगिक, पहली बार शार्क के जिगर में खोजा गया था)। पेंटाइल रेडिकल (सी 5 एच 11) का तुच्छ नाम एमाइल है। यह ग्रीक से आता है. एमाइलॉन- स्टार्च: एक समय में, आइसोमाइल अल्कोहल सी 5 एच 11 ओएच (3-मिथाइलबुटानोल -1) को "किण्वन का एमाइल अल्कोहल" कहा जाता था, क्योंकि यह फ़्यूज़ल तेल का आधार बनता है, और यह किण्वन के परिणामस्वरूप बनता है शर्करायुक्त पदार्थों के - स्टार्च हाइड्रोलिसिस के उत्पाद।
साइक्लोअल्केन श्रृंखला का सबसे सरल सदस्य C एनएच 2 एन– साइक्लोप्रोपेन ( एन=3). इसके समरूपों को उपसर्ग "साइक्लो" (साइक्लोब्यूटेन, साइक्लोपेंटेन, आदि) के साथ अल्केन्स के समान कहा जाता है। साइक्लोअल्केन्स में, साइड एल्काइल समूहों की उपस्थिति और रिंग में उनके स्थान के कारण आइसोमेरिज्म संभव है। उदाहरण के लिए, साइक्लोहेक्सेन, मिथाइलसाइक्लोपेंटेन, 1,1-, 1,2- और 1,3-डाइमिथाइलसाइक्लोब्यूटेन, 1,1,2- और 1,2,3-ट्राइमिथाइलसाइक्लोप्रोपेन आइसोमेरिक हैं।
कार्बन परमाणुओं की बढ़ती संख्या के साथ एल्केन आइसोमर्स की संख्या तेजी से बढ़ती है। कुछ अल्केन्स के नाम, साथ ही उनके संभावित आइसोमर्स की सैद्धांतिक संख्या तालिका में दी गई है।
| FORMULA | नाम | आइसोमर्स की संख्या | FORMULA | नाम | आइसोमर्स की संख्या |
| सीएच 4 | मीथेन | 1 | सी 11 एन 24 | उंडेकन | 159 |
| सी 2 एच 6 | एटैन | 1 | सी 12 एन 26 | डोडेकन | 355 |
| सी 3 एच 8 | प्रोपेन | 1 | सी 13 एन 28 | ट्राइडेकन | 802 |
| सी 4 एच 10 | बुटान | 2 | सी 14 एन 30 | टेट्राडेकेन | 1858 |
| सी 5 एच 12 | पेंटेन | 3 | सी 15 एन 32 | पेंटाडेकेन | 4347 |
| सी 6 एच 14 | हेक्सेन | 5 | सी 20 एन 42 | ईकोसन | 366319 |
| सी 7 एच 16 | हेपटैन | 9 | सी 25 एन 52 | पेंटाकोसन | 36797588 |
| सी 8 एच 18 | ओकटाइन | 18 | सी 30 एन 62 | ट्राईकॉन्टन | 4111846763 |
| सी 9 एच 20 | नॉनन | 35 | सी 40 एन 82 | टेट्राकोंटन | 62481801147341 |
| सी 10 एच 22 | डीन | 75 | सी 100 एन 202 | हेक्टेन | लगभग 5.921 10 39 |
संतृप्त हाइड्रोकार्बन के अधिकांश नामकरण नामों को समझना उन लोगों के लिए भी बहुत मुश्किल नहीं है, जिन्होंने शास्त्रीय व्यायामशाला में ग्रीक का अध्ययन नहीं किया है। ये नाम प्रत्यय -an के योग के साथ ग्रीक अंकों से आए हैं। श्रृंखला के पहले सदस्यों के साथ यह अधिक कठिन है: वे अंकों का उपयोग नहीं करते हैं, बल्कि संबंधित अल्कोहल या एसिड के नाम से जुड़ी अन्य ग्रीक जड़ों का उपयोग करते हैं। ये अल्कोहल और एसिड संबंधित अल्केन्स की खोज से बहुत पहले से ज्ञात थे; इसका एक उदाहरण एथिल अल्कोहल और ईथेन है (केवल 1848 में प्राप्त हुआ)।
मीथेन (साथ ही मेथनॉल, मिथाइल, मेथिलीन, आदि) की एक सामान्य जड़ "मेट" होती है, जो रसायन विज्ञान में एक कार्बन परमाणु वाले समूह को दर्शाती है: मिथाइल सीएच 3, मेथिलीन (मिथाइलिडीन) सीएच 2, मिथाइलिन (मिथाइलिडाइन) सीएच। ऐतिहासिक रूप से, पहला ऐसा पदार्थ मिथाइल (लकड़ी के रूप में भी जाना जाता है) अल्कोहल, मेथनॉल था, जो पहले लकड़ी के सूखे आसवन द्वारा प्राप्त किया जाता था। इसका नाम ग्रीक शब्द मेथी से आया है - नशीला वाइन और हिले - जंगल (जैसा कि कहा जा सकता है, "लकड़ी की वाइन")। यहां सबसे आश्चर्यजनक बात यह है कि मीथेन, नीलम और शहद की जड़ एक समान है! प्राचीन काल में, कीमती पत्थर जादुई गुणों से संपन्न थे (और कई लोग अभी भी इस पर विश्वास करते हैं)। इस प्रकार, यह माना जाता था कि सुंदर बैंगनी पत्थर नशे से बचाते हैं, खासकर अगर पीने का प्याला इस पत्थर से बनाया गया हो। नकारात्मक उपसर्ग के साथ, यह एमेथिस्टोस निकला - नशा का प्रतिकार करने वाला। यह पता चला है कि शहद शब्द लगभग सभी यूरोपीय भाषाओं में मौजूद है: अंग्रेजी। मीड - शहद (पेय के रूप में), जर्मन मेट (पुराने जर्मन मेटू में), डच मेडे, स्वीडिश एमजॉड, डेनिश एमजॉड, लिथुआनियाई और लातवियाई मेडस, स्लाव भाषाओं का उल्लेख नहीं है। ग्रीक सहित ये सभी शब्द इंडो-यूरोपीय मेधु से आए हैं, जिसका अर्थ है मीठा पेय। ग्रीक ब्रांडी मेटाक्सा भी उनसे बहुत पीछे नहीं है, हालाँकि यह बिल्कुल भी मीठी नहीं है।
ईथेन (साथ ही ईथर, इथेनॉल, अल्कोहल, एल्केन) की उत्पत्ति एक समान है। प्राचीन यूनानी दार्शनिकों ने ब्रह्मांड में व्याप्त एक निश्चित पदार्थ का वर्णन करने के लिए ऐथेर शब्द का उपयोग किया था। जब आठवीं शताब्दी में कीमियागर थे। उन्होंने वाइन अल्कोहल और सल्फ्यूरिक एसिड से आसानी से वाष्पित होने वाला तरल पदार्थ प्राप्त किया, इसे सल्फ्यूरिक ईथर कहा गया। 19 वीं सदी में पता चला कि सल्फ्यूरिक ईथर (अंग्रेजी में ईथर) तथाकथित ईथर से संबंधित है और इसमें दो कार्बन परमाणुओं का एक समूह होता है - एथिल अल्कोहल (इथेनॉल) के समान; इस समूह को एथिल कहा जाता था। इस प्रकार, पदार्थ का नाम "एथिल ईथर" (सी 2 एच 5 -ओ-सी 2 एच 5) मूलतः "तेल तेल" है।
ईथेन नाम "एथिल" से आया है। इथेनॉल, अल्कोहल के नामों में से एक, अल्केन शब्द (एल्केन, एल्काइन, एल्काइल) के समान मूल का है। अरबी में अल-कोहल का मतलब पाउडर, पाउडर, धूल होता है। थोड़ी सी सांस लेते ही वे शराब के वाष्प की तरह हवा में उठ जाते हैं - "शराब की शराब", जो समय के साथ बस शराब में बदल जाती है।
"एथेन" और "इथेनॉल" में "टी" और "ईथर" में "एफ" क्यों है? आख़िरकार, अंग्रेजी में, रूसी के विपरीत, "ईथर" और "एथिल" शब्दों की वर्तनी और ध्वनियाँ समान हैं। संयोजन th ग्रीक अक्षर q (थीटा) पर वापस जाता है; 1918 तक रूसी भाषा में, अक्षर "फ़िता" की शैली वही थी, जिसे, हालांकि, "एफ" के रूप में उच्चारित किया जाता था और इसका उपयोग उन शब्दों को अलग करने के एकमात्र उद्देश्य के लिए किया जाता था जिनमें यह अक्षर ग्रीक क्यू और 247 (" फाई”)। पश्चिमी यूरोपीय भाषाओं में, ग्रीक। जे पीएच पर गया, और क्यू वें पर गया। रूसी भाषा में, 18वीं शताब्दी में कई शब्दों में "फ़िता" शामिल था। अक्षर "f" द्वारा प्रतिस्थापित किया गया: "qeaftr" के बजाय थिएटर, "maqematics" के बजाय गणित, "qeory" के बजाय सिद्धांत... इस संबंध में, यह दिलचस्प है कि 1882 में प्रकाशित डाहल के शब्दकोश में, यह है लिखित ईकिर, और ब्रॉकहॉस और एफ्रॉन (1904) के विश्वकोश शब्दकोश में - "ईथर"।
वैसे, पश्चिमी भाषाओं में एस्टर एस्टर हैं, ईथर नहीं। लेकिन "एस्टर" शब्द रूसी भाषा में मौजूद नहीं है, इसलिए कपड़ा उत्पादों के लेबल पर "पॉलिएस्टर", "पॉलिएस्टर फाइबर" (पॉलिएस्टर) के बजाय "पॉलिएस्टर" के रूप में अंग्रेजी पॉलिएस्टर के अनपढ़ अनुवाद से किसी भी रसायनज्ञ की आँखें आहत होती हैं। उदाहरण के लिए, लैवसन, टेरीलीन, डैक्रॉन) शामिल हैं।
"प्रोपेन" और "ब्यूटेन" नाम संबंधित एसिड के नामों से आते हैं - प्रोपियोनिक और ब्यूटानोइक (ब्यूटिरिक)। प्रोपियोनिक एसिड वसा में पाया जाने वाला "पहला" (यानी सबसे छोटी श्रृंखला) है ( सेमी. वसा और तेल), और इसका नाम ग्रीक से लिया गया है। प्रोटो- प्रथम और पिओन- मोटा। ब्यूटेन और ब्यूटेनोइक एसिड ब्यूटिरिक अम्ल) - ग्रीक से। ब्यूटिरॉन- तेल; रूसी में, ब्यूटिरेट्स ब्यूटिरिक एसिड के लवण और एस्टर हैं। यह एसिड तब निकलता है जब तेल बासी हो जाता है।
इसके अलावा, पेंटेन से शुरू करके, नाम ग्रीक अंकों से लिए गए हैं। एक दुर्लभ अपवाद सीटेन है, जो सी16 हेक्साडेकेन के नामों में से एक है। यह शब्द सेटिल अल्कोहल नाम से आया है, जिसे 1823 में फ्रांसीसी रसायनज्ञ मिशेल यूजीन शेवरूल ने प्राप्त किया था। शेवरुल ने इस पदार्थ को स्पर्मेसेटी से अलग किया, जो शुक्राणु व्हेल के सिर से एक मोमी पदार्थ है। स्पर्मेसेटी शब्द ग्रीक स्पर्मा - बीज और केटोस - बड़े समुद्री जानवर (व्हेल, डॉल्फ़िन) से आया है। दूसरे शब्द (सीटस) की लैटिन वर्तनी से सेटिल अल्कोहल सी 16 एच 33 ओएच (हेक्साडेकेनॉल) और सीटेन आता है।
रूसी भाषा में अल्केन्स के समान मूल वाले कई शब्द हैं: पेंटागन, हेप्टाकोर्ड (7 चरणों का ध्वनि पैमाना), डोडेकैफोनी (संगीत रचना की विधि), ऑक्टेव, डेसिमा और अनडेसिमा (संगीत अंतराल), ऑक्टेट और नॉनट (समान संयोजन) 8 और 9 संगीतकार), पेंटोड, हेक्सोड और हेप्टोड (रेडियो ट्यूब); हेक्सामीटर (काव्य मीटर), अष्टफलक, दशक, दशक, हेक्टेयर, अक्टूबर, दिसंबर, आदि। और इसी तरह।
सबसे लंबे अणुओं वाले अल्केन को 1985 में अंग्रेजी रसायनज्ञों द्वारा संश्लेषित किया गया था। यह नॉनकॉन्टैट्रिक्टन सी 390 एच 782 है, जिसमें 390 कार्बन परमाणुओं की एक श्रृंखला होती है। शोधकर्ता इस बात में रुचि रखते थे कि क्रिस्टलीकरण के दौरान ऐसी लंबी श्रृंखलाएं कैसे पैक होंगी (लचीली हाइड्रोकार्बन श्रृंखलाएं आसानी से मुड़ सकती हैं)।
अल्केन्स के आइसोमर्स की संख्या।
अल्केन्स के आइसोमर्स की सैद्धांतिक रूप से संभावित संख्या की समस्या को सबसे पहले अंग्रेजी गणितज्ञ आर्थर केली (1821-1895) ने हल किया था, जो गणित की एक महत्वपूर्ण शाखा - टोपोलॉजी के संस्थापकों में से एक थे (1879 में उन्होंने प्रसिद्ध पर पहला लेख प्रकाशित किया था) चार रंगों की समस्या": क्या उनमें से किसी भी भौगोलिक कार्ड को रंगने के लिए पर्याप्त हैं; यह समस्या केवल 1976 में हल हो गई थी)। यह पता चला कि ऐसा कोई सूत्र नहीं है जिसके द्वारा कोई सी अल्केन में कार्बन परमाणुओं की संख्या का उपयोग कर सके एनएच 2 एन+2 इसके आइसोमर्स की संख्या की गणना करें। केवल तथाकथित आवर्ती सूत्र हैं (लैटिन से)। पुनरावृत्ति- रिटर्निंग), जो आपको आइसोमर्स की संख्या की गणना करने की अनुमति देता है एनश्रृंखला का वां सदस्य, यदि पिछले सदस्य के आइसोमर्स की संख्या पहले से ही ज्ञात है। इसलिए, बड़े के लिए गणना एनअपेक्षाकृत हाल ही में कंप्यूटर का उपयोग करके प्राप्त किए गए और हाइड्रोकार्बन सी 400 एच 802 में घटा दिए गए; इसके लिए, स्थानिक आइसोमर्स को ध्यान में रखते हुए, एक ऐसा मान प्राप्त किया गया जिसकी कल्पना करना मुश्किल है: 4.776·10 199। और अल्केन सी 167 एच 336 से शुरू होकर, आइसोमर्स की संख्या ब्रह्मांड के दृश्य भाग में प्राथमिक कणों की संख्या से अधिक है, जिसका अनुमान 10 80 है। यदि हम दर्पण-सममित अणुओं - स्टीरियोइसोमर्स ( सेमी. ऑप्टिकल आइसोमेरिज्म): हेप्टेन के लिए - 9 से 11 तक, डिकैन के लिए - 75 से 136 तक, ईकोसेन के लिए - 366,319 से 3,396,844 तक, हेक्टेन के लिए - 5.921 10 39 से 1.373 10 46 तक, आदि।
एक रसायनज्ञ के दृष्टिकोण से, संतृप्त हाइड्रोकार्बन के संरचनात्मक आइसोमर्स की संख्या केवल श्रृंखला के पहले सदस्यों के लिए व्यावहारिक रुचि है। यहां तक कि केवल डेढ़ दर्जन कार्बन परमाणुओं वाले अपेक्षाकृत सरल अल्केन के लिए भी, आइसोमर्स की भारी संख्या प्राप्त नहीं की गई है और कभी भी संश्लेषित होने की संभावना नहीं है। उदाहरण के लिए, सैद्धांतिक रूप से संभव डिकैन के 75 आइसोमर्स में से अंतिम को केवल 1968 में संश्लेषित किया गया था। और यह व्यावहारिक उद्देश्यों के लिए किया गया था - मानक यौगिकों का एक अधिक संपूर्ण सेट प्राप्त करने के लिए जिसके द्वारा विभिन्न हाइड्रोकार्बन, उदाहरण के लिए, तेल में पाए जाने वाले, को संश्लेषित किया जा सकता है। पहचाना जाए. वैसे, सभी 18 संभावित ऑक्टेन आइसोमर्स विभिन्न प्रकार के तेल में पाए गए हैं।
लेकिन सबसे दिलचस्प बात यह है कि, हेप्टाडेकेन सी 17 एच 36 से शुरू करते हुए, पहले तो केवल कुछ सैद्धांतिक रूप से संभव आइसोमर्स की संख्या, फिर कई, और अंत में लगभग सभी "पेपर केमिस्ट्री" का एक शानदार उदाहरण हैं, यानी। वास्तविकता में अस्तित्व में नहीं हो सकता. तथ्य यह है कि जैसे-जैसे शाखित आइसोमर्स के अणुओं में कार्बन परमाणुओं की संख्या बढ़ती है, स्थानिक पैकिंग की गंभीर समस्याएँ उत्पन्न होती हैं। आख़िरकार, गणितज्ञों ने कार्बन और हाइड्रोजन परमाणुओं को बिंदुओं के रूप में माना, जबकि वास्तव में उनकी एक सीमित त्रिज्या होती है। इस प्रकार, एक मीथेन "बॉल" की "सतह" पर 4 हाइड्रोजन परमाणु होते हैं, जो उस पर स्वतंत्र रूप से रखे जाते हैं। नियोपेंटेन सी(सीएच 3) 4 में "सतह" पर पहले से ही 12 हाइड्रोजन परमाणु हैं, जो एक दूसरे के बहुत करीब स्थित हैं; लेकिन अभी भी उन्हें रखे जाने की जगह है। लेकिन अल्केन 4 (सी 17 एच 36) के लिए, 12 मिथाइल समूहों में सभी 36 हाइड्रोजन परमाणुओं को समायोजित करने के लिए सतह पर पर्याप्त जगह नहीं है; यह जांचना आसान है कि क्या आप समान आइसोमर्स के लिए एक सपाट छवि बनाते हैं (या इससे भी बेहतर, प्लास्टिसिन और माचिस से एक त्रि-आयामी मॉडल बनाते हैं), सी-सी और सी-एच बांड की लंबाई और बीच के सभी कोणों की स्थिरता बनाए रखते हैं। उन्हें)। विकास के साथ एनकार्बन परमाणुओं के लिए प्लेसमेंट समस्याएँ भी उत्पन्न होती हैं। नतीजतन, इस तथ्य के बावजूद कि संभावित आइसोमर्स की संख्या बढ़ रही है एनबहुत तेजी से बढ़ता है, "पेपर" आइसोमर्स का हिस्सा बहुत तेजी से बढ़ता है। एक कंप्यूटर-आधारित मूल्यांकन से पता चला कि एनवास्तव में संभावित आइसोमर्स की संख्या और "पेपर" आइसोमर्स की संख्या का अनुपात तेजी से शून्य के करीब पहुंच जाता है। इसीलिए बड़े पैमाने पर संतृप्त हाइड्रोकार्बन के आइसोमर्स की सटीक संख्या की गणना की जाती है एन, जो एक समय काफी रुचि जगाता था, अब रसायनज्ञों के लिए केवल सैद्धांतिक महत्व रह गया है।
अल्केन्स की संरचना और भौतिक गुण।
अल्केन्स में कार्बन परमाणु के चार एसपी 3 हाइब्रिड ऑर्बिटल्स होते हैं ( सेमी. ऑर्बिटल्स) को टेट्राहेड्रोन के शीर्षों की ओर निर्देशित किया जाता है, जिनके बीच लगभग 109°28" का कोण होता है - यह इस मामले में है कि इलेक्ट्रॉनों और सिस्टम की ऊर्जा के बीच प्रतिकर्षण न्यूनतम है। इन ऑर्बिटल्स के ओवरलैप के परिणामस्वरूप एक दूसरे के साथ भी, साथ ही साथ भी एस-हाइड्रोजन परमाणुओं के कक्षक s-आबंध C-C और C-H बनाते हैं। एल्केन अणुओं में ये बंधन सहसंयोजक गैर-ध्रुवीय या निम्न-ध्रुवीय होते हैं।
अल्केन्स को प्राथमिक कार्बन परमाणुओं में विभाजित किया जाता है (वे केवल एक पड़ोसी सी परमाणु से बंधे होते हैं), माध्यमिक (दो सी परमाणुओं से बंधे होते हैं), तृतीयक (तीन सी परमाणुओं से बंधे होते हैं) और चतुर्धातुक (चार सी परमाणुओं से बंधे होते हैं)। इस प्रकार, 2,2-डाइमिथाइल-3-मिथाइलपेंटेन सीएच 3 -सी (सीएच 3) 2 -सीएच (सीएच 3) - सीएच 2 -सीएच 3 में एक चतुर्धातुक, एक तृतीयक, एक द्वितीयक और पांच प्राथमिक कार्बन परमाणु होते हैं। कार्बन परमाणुओं के विभिन्न वातावरण उनसे जुड़े हाइड्रोजन परमाणुओं की प्रतिक्रियाशीलता को बहुत प्रभावित करते हैं।
एसपी 3 ऑर्बिटल्स की स्थानिक व्यवस्था, प्रोपेन से शुरू होकर, कार्बन श्रृंखलाओं के ज़िगज़ैग विन्यास की ओर ले जाती है। इस मामले में, सी-सी बांड के चारों ओर आणविक टुकड़ों का घूमना संभव है (20 डिग्री सेल्सियस पर ईथेन अणु में - प्रति सेकंड लाखों क्रांतियों की गति से!), जो उच्च अल्केन्स के अणुओं को लचीला बनाता है। ऐसी श्रृंखलाओं का सीधा होना, उदाहरण के लिए, पॉलीथीन को खींचते समय होता है, जिसमें लंबी श्रृंखलाओं वाले अल्केन्स का मिश्रण होता है। अल्केन अणु एक-दूसरे के साथ कमजोर रूप से बातचीत करते हैं, इसलिए ध्रुवीय अणुओं वाले समान पदार्थों की तुलना में अल्केन्स बहुत कम तापमान पर पिघलते और उबलते हैं। मीथेन की सजातीय श्रृंखला के पहले 4 सदस्य सामान्य परिस्थितियों में गैसें हैं; प्रोपेन और ब्यूटेन को कम दबाव में आसानी से तरलीकृत किया जाता है (एक तरल प्रोपेन-ब्यूटेन मिश्रण घरेलू गैस सिलेंडर में निहित होता है)। उच्च समजात गैसोलीन की गंध वाले तरल पदार्थ या ठोस पदार्थ होते हैं जो पानी में अघुलनशील होते हैं और इसकी सतह पर तैरते हैं। अणु में कार्बन परमाणुओं की बढ़ती संख्या के साथ अल्केन्स के पिघलने और क्वथनांक बढ़ते हैं, जबकि तापमान में वृद्धि धीरे-धीरे धीमी हो जाती है, उदाहरण के लिए, सी 100 एच 202 115 डिग्री सेल्सियस पर पिघलता है, सी 150 एच 302 - 123 डिग्री सेल्सियस पर पिघलता है। और पहले 25 अल्केन्स के क्वथनांक तालिका में दिए गए हैं - यह स्पष्ट है कि ऑक्टाडेकेन से शुरू करके, अल्केन्स ठोस हैं।
| मेज़। अल्केन्स का पिघलना और उबलना तापमान | ||
| एल्केन | टीपी एल | टीगांठ |
| मीथेन | –182,5 | –161,5 |
| एटैन | –183,3 | –88,6 |
| प्रोपेन | –187,7 | –42,1 |
| बुटान | –138,4 | –0,5 |
| पेंटेन | –129,7 | 36,1 |
| हेक्सेन | –95,3 | 68,7 |
| हेपटैन | –90,6 | 98,4 |
| ओकटाइन | –56,8 | 125,7 |
| नॉनन | –51,0 | 150,8 |
| डीन | –29,7 | 174,1 |
| उंडेकन | –25,6 | 195,9 |
| डोडेकन | –9,6 | 216,3 |
| ट्राइडेकन | –5,5 | 235,4 |
| टेट्राडेकेन | +5,9 | 253,7 |
| पेंटाडेकेन | +9,9 | 270,6 |
| हेक्साडेकेन | 18,2 | 286,8 |
| हेप्टाडेकेन | 22,0 | 301,9 |
| ऑक्टाडेकन | 28,2 | 316,1 |
| नॉनडेकेन | 32,1 | 329,7 |
| ईकोसन | 36,8 | 342,7 |
| जिनीकोज़ान | 40,5 | 356,5 |
| डोकोज़न | 44,4 | 368,6 |
| ट्राइकोज़न | 47,6 | 378,3 |
| टेट्राकोसेन | 50,9 | 389,2 |
| पेंटाकोसन | 53,7 | 399,7 |
श्रृंखला में एक शाखा की उपस्थिति भौतिक गुणों, विशेषकर गलनांक को नाटकीय रूप से बदल देती है। इसलिए, यदि हेक्सेन की संरचना सामान्य है ( एन-हेक्सेन) -95.3 डिग्री सेल्सियस पर पिघलता है, फिर इसका आइसोमेरिक 2-मिथाइलपेंटेन -153.7 डिग्री सेल्सियस पर पिघलता है। यह उनके क्रिस्टलीकरण के दौरान शाखित अणुओं को पैक करने की कठिनाई के कारण होता है। परिणामस्वरूप, श्रृंखला शाखाओं वाले अल्केन्स तेजी से ठंडा होने पर क्रिस्टलीकृत नहीं होते हैं, बल्कि एक सुपरकूल्ड तरल की कांच जैसी अवस्था में बदल जाते हैं ( सेमी. काँच)। उदाहरण के लिए, यदि पेंटेन की एक पतली शीशी को तरल नाइट्रोजन (तापमान -196 डिग्री सेल्सियस) में डुबोया जाता है, तो पदार्थ सफेद बर्फ जैसे द्रव्यमान में बदल जाएगा, जबकि आइसोपेंटेन (2-मिथाइलब्यूटेन) एक पारदर्शी "ग्लास" में जम जाता है।
उन्हें अलग करने की एक मूल विधि रैखिक और शाखित अल्केन्स के ज्यामितीय आकार में अंतर पर आधारित है: यूरिया क्रिस्टल में चैनल होते हैं जिनमें सीधी-श्रृंखला वाले अल्केन्स फिट हो सकते हैं, लेकिन शाखित अल्केन्स फिट नहीं हो सकते हैं।
साइक्लोऐल्केन के साथ एन= 2, 3 - गैसें, उच्चतर - तरल या ठोस। सबसे बड़ा चक्र जिसे रसायनशास्त्री संश्लेषित करने में सक्षम हुए हैं वह साइक्लोऑक्टाओक्टाकॉन्टेडिक्टेन सी 288 एच 576 है। अणु में कार्बन परमाणुओं की सम और विषम संख्या के साथ साइक्लोअल्केन अणुओं के विभिन्न आकार पिघलने बिंदु के संबंध में एक मजबूत सम-विषम प्रभाव पैदा करते हैं, जैसा कि तालिका से देखा जा सकता है। इस प्रभाव को क्रिस्टल में विभिन्न आकृतियों के अणुओं की पैकिंग की "सुविधा" में अंतर से समझाया गया है: पैकिंग जितनी अधिक सघन होगी, क्रिस्टल उतना ही मजबूत होगा और उसका गलनांक उतना ही अधिक होगा। उदाहरण के लिए, साइक्लोडोडकेन अपने निकटतम समरूप, साइक्लाउंडेकेन से लगभग 70° अधिक पिघलता है। बेशक, अणु का द्रव्यमान भी मायने रखता है: प्रकाश अणु कम तापमान पर पिघलते हैं।
| सी 3 एच 6 | –127,5 |
| सी 4 एच 8 | –50 |
| सी 5 एच 10 | –93,9 |
| सी 6 एच 12 | +6,5 |
| सी 7 एच 14 | –12 |
| सी 8 एच 16 | 14,3 |
| एस 9 एच 18 | 9,7 |
| सी 10 एन 20 | 10,8 |
| सी 11 एन 22 | –7,2 |
| सी 12 एच 24 | 61,6 |
| सी 13 एन 26 | 23,5 |
| सी 14 एन 28 | 54 |
| सी 15 एन 30 | 62,1 |
सी-सी बंधन के चारों ओर घूमने में आसानी इस तथ्य की ओर ले जाती है कि साइक्लोअल्केन्स के अणु समतल नहीं होते हैं (साइक्लोप्रोपेन के अपवाद के साथ), इस तरह वे बंधन कोणों के मजबूत विरूपण से बचते हैं। इस प्रकार, साइक्लोहेक्सेन और इसके उच्च समरूपों में बंधन कोण शिथिल होते हैं और टेट्राहेड्रल (109°) के करीब होते हैं, जबकि एक षट्भुज में कोण 120° होते हैं, एक अष्टकोण में - 135°, आदि। ऐसे साइक्लोअल्केन्स में व्यक्तिगत कार्बन परमाणु एक कठोर निश्चित स्थिति पर कब्जा नहीं करते हैं: वलय निरंतर तरंग जैसी गति में प्रतीत होता है। इस प्रकार, एक साइक्लोहेक्सेन अणु विभिन्न ज्यामितीय संरचनाओं (अनुरूपकों) के रूप में हो सकता है जो एक दूसरे में परिवर्तित हो सकते हैं (चक्र व्युत्क्रम)। उनकी बाहरी समानता के कारण, उन्हें "बाथटब" और "कुर्सी" कहा जाता था (अंग्रेजी साहित्य में, "बाथटब" को "नाव" कहा जाता है):
कुर्सी का आकार अधिक स्थिर है; सामान्य तापमान पर, 99.9% साइक्लोहेक्सेन अधिक स्थिर कुर्सी रूप में मौजूद होता है। दो रूपों के बीच संक्रमण एक मध्यवर्ती "ट्विस्ट कन्फॉर्मेशन" (अंग्रेजी से) के माध्यम से होता है। मोड़- मोड़)।
साइक्लोप्रोपेन में, कोण 108° से घटकर 60° हो जाता है, जिसके परिणामस्वरूप उच्च तनाव और "मुड़े हुए" बंधन बनते हैं जो सामान्य एस- और पी-बंधों के बीच मध्यवर्ती होते हैं; अपने आकार के कारण, इन बांडों को "केला" बांड कहा जाता है। इस मामले में, कार्बन परमाणुओं के एसपी 3 ऑर्बिटल्स केवल आंशिक रूप से ओवरलैप होते हैं। इसका परिणाम साइक्लोप्रोपेन के रासायनिक गुणों में द्वंद्व है। एक ओर, इसमें हाइड्रोजन परमाणुओं का प्रतिस्थापन संभव है (अल्केन्स की एक विशिष्ट प्रतिक्रिया), दूसरी ओर, रिंग खोलने के साथ जोड़ संभव है (एल्केन्स की विशिष्ट प्रतिक्रिया, उदाहरण के लिए: साइक्लो-C 3 H 6 + Br 2 ® BrCH 2 CH 2 CH 2 Br).
दो वलय और एक सामान्य कार्बन परमाणु वाले साइक्लोअल्केन्स को स्पाइरोअल्केन्स कहा जाता है। यदि दो से अधिक सामान्य कार्बन परमाणु हैं, तो बाइसाइक्लोअल्केन्स, ट्राइसाइक्लोअल्केन्स आदि बनते हैं। एक साथ कई चक्रों के ऐसे "क्रॉस-लिंकिंग" के परिणामस्वरूप, रसायनज्ञ हाइड्रोकार्बन प्राप्त करने में कामयाब रहे, जिनकी स्थानिक संरचना विभिन्न से मेल खाती है पॉलीहेड्रा: टेट्राहेड्रोन, क्यूब, प्रिज्म, आदि। बाइसिकल डेरिवेटिव साइक्लोहेक्सेन आवश्यक तेलों, शंकुधारी राल और तारपीन में पाए जाते हैं। कपूर, कोलेस्ट्रॉल, सैकरीन, पिपेरिन (यह काली मिर्च को तीखा स्वाद देता है), नाइट्रोजनस आधार - न्यूक्लियोटाइड और अन्य यौगिकों में छह और पांच कार्बन परमाणुओं का एक चक्र पाया जाता है (चक्र में कुछ कार्बन परमाणु दोहरे बंधन द्वारा जुड़े हो सकते हैं) , और कुछ को अन्य परमाणुओं द्वारा प्रतिस्थापित किया जाता है, जैसे सैकरीन में)। 17 कार्बन परमाणुओं का एक चक्र (उनमें से दो दोहरे बंधन से जुड़े हुए हैं) सिवेटन, एक गंधयुक्त पदार्थ, कस्तूरी का एक घटक, में निहित है, जिसका उपयोग इत्र में किया जाता है। खूबसूरत एडामेंटेन अणु में तीन छह-सदस्यीय छल्ले होते हैं और इसकी संरचना हीरे के क्रिस्टल जाली से मेल खाती है। एडामेंटेन संरचना एंटीवायरल दवा रिमांटाडाइन, हेक्सामेथिलनेटेट्रामाइन में पाई जाती है (बाद वाले यौगिक में, 4 कार्बन परमाणुओं को नाइट्रोजन परमाणुओं द्वारा प्रतिस्थापित किया जाता है, जो मिथाइलीन पुलों - सीएच 2 - द्वारा एक दूसरे से जुड़े होते हैं)। नीचे कुछ साइक्लोअल्केन्स की संरचनाएं दी गई हैं, जिनके अणुओं में एक से अधिक अलग-अलग जुड़े हुए छल्ले होते हैं।
बाइसाइक्लोडेकेन (टेट्राहाइड्रोनफैथलीन, डेकालिन)
एडमैंटेन
अल्केन्स के रासायनिक गुण।
अल्केन्स सबसे कम रासायनिक रूप से सक्रिय कार्बनिक यौगिक हैं। अल्केन्स में सभी सी-सी और सी-एच बांड एकल होते हैं, इसलिए अल्केन्स अतिरिक्त प्रतिक्रियाओं में असमर्थ होते हैं। अल्केन्स को अन्य परमाणुओं और परमाणुओं के समूहों के साथ हाइड्रोजन परमाणुओं के प्रतिस्थापन की प्रतिक्रियाओं की विशेषता है। इस प्रकार, जब मीथेन को क्लोरीनीकृत किया जाता है, तो मिथाइल क्लोराइड सीएच 3 सीएल, मेथिलीन क्लोराइड सीएच 2 सीएल 2, ट्राइक्लोरोमेथेन (क्लोरोफॉर्म) सीएचसीएल 3 और कार्बन टेट्राक्लोराइड (कार्बन टेट्राक्लोराइड) सीसीएल 4 बनते हैं। ये प्रतिक्रियाएं मुक्त कणों के मध्यवर्ती गठन के साथ एक श्रृंखला तंत्र का पालन करती हैं।
प्रोपेन से शुरू करके अल्केन्स का क्लोरीनीकरण करते समय, पहला क्लोरीन परमाणु विभिन्न हाइड्रोजन परमाणुओं को प्रतिस्थापित कर सकता है। प्रतिस्थापन की दिशा सी-एच बंधन की ताकत पर निर्भर करती है: यह जितना कमजोर होगा, इस विशेष परमाणु का प्रतिस्थापन उतना ही तेज होगा। प्राथमिक सी-एच बांड आमतौर पर द्वितीयक बांड की तुलना में अधिक मजबूत होते हैं, और द्वितीयक बांड तृतीयक बांड की तुलना में अधिक मजबूत होते हैं। परिणामस्वरूप, द्वितीयक बंधन (सीएच 3) 2 सीएच-एच के साथ 25 डिग्री सेल्सियस पर क्लोरीनीकरण प्राथमिक बंधन सी 2 एच 5-एच और तृतीयक बंधन (सीएच 3) 3 सी-एच - की तुलना में 4.5 गुना तेजी से होता है। 6.7 गुना तेज गति से। प्राथमिक, द्वितीयक और तृतीयक हाइड्रोजन परमाणुओं की अलग-अलग प्रतिक्रियाशीलता के परिणामस्वरूप कई संभावित क्लोरीनीकरण उत्पादों में से केवल एक ही प्रमुख हो सकता है। उदाहरण के लिए, जब 2,3-डाइमिथाइलब्यूटेन को कार्बन डाइसल्फ़ाइड (सीएस 2) के घोल में क्लोरीनीकृत किया जाता है, तो 2-क्लोरो व्युत्पन्न का 95% और 1-क्लोरो व्युत्पन्न का केवल 5% बनता है, अर्थात। 19 गुना कम. यदि हम इस बात को ध्यान में रखें कि मूल अल्केन में तृतीयक की तुलना में 6 गुना अधिक प्राथमिक हाइड्रोजन परमाणु हैं, तो उनकी प्रतिक्रियाशीलता का अनुपात और भी अधिक होगा (19 ґ 6 = 114)। विलायक के रूप में कार्बन डाइसल्फ़ाइड क्लोरीन परमाणुओं की प्रतिक्रियाशीलता को कम करता है और तदनुसार इसकी चयनात्मकता को बढ़ाता है। तापमान कम करना उसी तरह काम करता है।
ब्रोमीन परमाणु कम सक्रिय होते हैं; इस प्रतिक्रिया की ध्यान देने योग्य सक्रियण ऊर्जा इस तथ्य की ओर ले जाती है कि अल्केन्स का ब्रोमिनेशन, हालांकि यह एक श्रृंखला तंत्र द्वारा होता है, क्लोरीनीकरण की तुलना में बहुत धीमा होता है, और केवल ऊंचे तापमान पर या प्रकाश में होता है। ब्रोमीन परमाणुओं की कम गतिविधि से ब्रोमीन की चयनात्मकता भी बढ़ जाती है। इस प्रकार, यदि 40 डिग्री सेल्सियस पर इथेन के फोटोकैमिकल ब्रोमिनेशन की सापेक्ष दर 1 के बराबर ली जाती है, तो प्रोपेन के ब्रोमिनेशन की दर (द्वितीयक एच परमाणु पर) पहले से ही समान परिस्थितियों में 220 होगी, और ब्रोमिनेशन की दर आइसोब्यूटेन (तृतीयक एच परमाणु पर) 19,000 होगा
आयोडीन परमाणु सबसे कम सक्रिय होते हैं, इसलिए अल्केन्स RH + I 2 ® RI + HI के आयोडीनीकरण की प्रतिक्रिया एंडोथर्मिक होती है, जो केवल उच्च तापमान पर संभव होती है और बहुत छोटी श्रृंखलाओं के साथ होती है। इसके अलावा, रिवर्स एक्ज़ोथिर्मिक प्रतिक्रिया आरआई + एचआई® आरएच + आई 2 बहुत आसानी से होती है। जब ऐल्केनों को आयोडीनित किया जाता है तो असंतृप्त यौगिक भी बनते हैं। उदाहरण के लिए, 685°C पर, इथेन, आयोडीन के साथ प्रतिक्रिया करके 72% एथिलीन और 10% एसिटिलीन बनाता है। प्रोपेन, ब्यूटेन और पेंटेन के साथ भी यही परिणाम प्राप्त हुए।
मूल अल्केन के सभी संभावित पॉलीफ्लोरिनेटेड डेरिवेटिव के गठन के साथ अल्केन्स की फ्लोरीनेशन प्रतिक्रिया बहुत उच्च, अक्सर विस्फोटक दर पर आगे बढ़ती है। अल्केन्स के फ्लोरिनेशन के दौरान निकलने वाली ऊर्जा इतनी अधिक होती है कि यह उत्पाद अणुओं को रेडिकल्स में तोड़ने का कारण बन सकती है जो नई श्रृंखलाएं शुरू करती हैं। परिणामस्वरूप, प्रतिक्रिया दर हिमस्खलन की तरह बढ़ जाती है और इससे कम तापमान पर भी विस्फोट हो जाता है। अल्केन्स के फ्लोरिनेशन की ख़ासियत अन्य हैलोजन के साथ अंतिम उत्पाद के रूप में सीएफ 4 के गठन के साथ फ्लोरीन परमाणुओं द्वारा कार्बन कंकाल के विनाश की संभावना है, ऐसी प्रतिक्रिया नहीं होती है।
अल्केन्स का नाइट्रेशन (कोनोवालोव की प्रतिक्रिया) भी एक कट्टरपंथी तंत्र का पालन करता है: आरएच + एनओ 2 ® आर· + एचएनओ 2, आर· + एनओ 2 ® आरएनओ 2। NO 2 का स्रोत नाइट्रिक एसिड है, जो गर्म करने पर विघटित हो जाता है। प्रतिक्रिया 150 डिग्री सेल्सियस से ऊपर के तापमान पर समाधान में या 10 एटीएम तक दबाव और 400 - 500 डिग्री सेल्सियस के तापमान पर वाष्प में की जाती है। बाद के मामले में, अल्केन्स में सी-सी बंधन भी टूट जाते हैं और मिश्रण होता है नाइट्रोऐल्केन बनता है।
सभी अल्केन्स गर्मी जारी करके जलते हैं, उदाहरण के लिए: C 5 H 12 + 8O 2 ® 5CO 2 + 6H 2 O. यह प्रतिक्रिया, विशेष रूप से, आंतरिक दहन इंजन के सिलेंडरों में होती है। बिना जले अल्केन्स के अवशेषों को वायुमंडल में प्रवेश करने से रोकने के लिए, उनके उत्प्रेरक आफ्टरबर्निंग का उपयोग निकास पाइपों में किया जाता है (उसी समय, CO को जलाया जाता है और नाइट्रोजन ऑक्साइड को हानिरहित नाइट्रोजन में परिवर्तित किया जाता है)। जब मोमबत्ती जलती है तो उच्च एल्केन्स (पैराफिन में) के साथ ऑक्सीजन की प्रतिक्रिया होती है। गैसीय अल्केन्स, जैसे मीथेन, हवा के साथ विस्फोटक मिश्रण बनाते हैं। ऐसे मिश्रण खदानों के साथ-साथ आवासीय भवनों में भी घरेलू गैस के रिसाव के कारण बन सकते हैं यदि हवा में इसकी मात्रा 5% तक पहुँच जाती है।
रसायनज्ञों के महत्वपूर्ण प्रयासों का उद्देश्य मूल्यवान मध्यवर्ती उत्पादों - एल्डिहाइड, कीटोन, अल्कोहल, कार्बोक्जिलिक एसिड के गठन के चरण में इसे रोकने के लिए अल्केन्स के कम तापमान ऑक्सीकरण की प्रतिक्रिया का विस्तृत अध्ययन करना था। इस प्रकार, Co(II) और Mn(II) लवण की उपस्थिति में, ब्यूटेन को एसिटिक एसिड में और पैराफिन को C12-C18 फैटी एसिड में ऑक्सीकृत किया जा सकता है। साइक्लोहेक्सेन के ऑक्सीकरण से कैप्रोलैक्टम, कैप्रोन और एडिपिक एसिड के उत्पादन के लिए एक मोनोमर का उत्पादन होता है।
एक महत्वपूर्ण औद्योगिक प्रतिक्रिया अल्केन्स का फोटोकैमिकल सल्फ़ोक्लोरिनेशन है: अल्केनसल्फोनिक एसिड क्लोराइड आरएसओ 2 सीएल के गठन के साथ सीएल 2 और एसओ 2 के साथ एक संयुक्त कट्टरपंथी श्रृंखला प्रतिक्रिया। डिटर्जेंट के उत्पादन में इस प्रतिक्रिया का व्यापक रूप से उपयोग किया जाता है। क्लोरीन को ऑक्सीजन के साथ प्रतिस्थापित करते समय, अल्केन्स के सल्फोनिक ऑक्सीकरण की एक श्रृंखला कट्टरपंथी प्रतिक्रिया अल्केनसल्फोनिक एसिड आर-एसओ 2-ओएच के गठन के साथ होती है। इन अम्लों के सोडियम लवणों का उपयोग डिटर्जेंट और इमल्सीफाइंग एजेंटों के रूप में किया जाता है।
उच्च तापमान पर, अल्केन्स का अपघटन (पाइरोलिसिस) होता है, उदाहरण के लिए: सीएच 4® सी + 2एच 2 (1000 डिग्री सेल्सियस), 2सीएच 4® सी 2 एच 2 + 3एच 2 (1500 डिग्री सेल्सियस), सी 2 एच 6® सी 2 एच 4 +एच2. अंतिम प्रतिक्रिया उत्प्रेरक (Ni) की उपस्थिति में 500°C पर होती है। इसी प्रकार, ब्यूटेन से 2-ब्यूटेन सीएच 3 सीएच = सीएचएच 3 प्राप्त किया जा सकता है, साथ ही एथिलीन और ईथेन का मिश्रण बनता है। इस कट्टरपंथी प्रतिक्रिया के विपरीत, अल्केन्स की उत्प्रेरक क्रैकिंग एक आयनिक तंत्र के माध्यम से आगे बढ़ती है और भारी पेट्रोलियम अंशों से गैसोलीन का उत्पादन करने का कार्य करती है। जब लुईस एसिड की उपस्थिति में गर्म किया जाता है, उदाहरण के लिए, AlCl 3, तो आइसोमेराइजेशन होता है: अशाखित (सामान्य) अल्केन्स समान संख्या में कार्बन परमाणुओं के साथ शाखित अल्केन्स में परिवर्तित हो जाते हैं। उच्च गुणवत्ता वाला मोटर ईंधन प्राप्त करने के लिए यह प्रतिक्रिया अत्यधिक व्यावहारिक महत्व रखती है ( सेमी. ऑक्टेन नंबर)। एल्केनों का डीहाइड्रोजनीकरण रिंग क्लोजर (डीहाइड्रोसायक्लाइजेशन) के साथ हो सकता है। हेक्सेन डीहाइड्रोसायक्लाइजेशन के मामले में, मुख्य उत्पाद बेंजीन है।
उत्प्रेरक की उपस्थिति में उच्च तापमान पर मीथेन जल वाष्प और कार्बन मोनोऑक्साइड (IV) के साथ प्रतिक्रिया करके संश्लेषण गैस बनाती है: CH 4 + H 2 O ® CO + 3H 2, CH 4 + CO 2 ® 2CO + 2H 2। सिंथेसिस गैस का उपयोग मोटर ईंधन और मिथाइल अल्कोहल के उत्पादन के लिए किया जाता है।
हाल के वर्षों में, रसायनज्ञों के प्रयासों का उद्देश्य ऐसे उत्प्रेरक बनाना है जो हल्की परिस्थितियों में अल्केन अणुओं में सी-एच बांड को सक्रिय करते हैं। कुछ सूक्ष्मजीव ऐसी प्रतिक्रियाएं "कर सकते हैं", जिनमें से एंजाइम प्रोटीन यौगिकों के निर्माण के साथ पैराफिन को भी "पचाने" में सक्षम होते हैं। रसायनज्ञों का कार्य यह समझना है कि प्राकृतिक उत्प्रेरक कैसे काम करते हैं और सामान्य तापमान पर होने वाली एंजाइमिक प्रतिक्रियाओं का मॉडल तैयार करना है। इस मामले में, विभिन्न ऑर्गेनोमेटेलिक यौगिकों का उपयोग उत्प्रेरक के रूप में किया जाता है। उदाहरण के लिए, कुछ प्लैटिनम यौगिकों की उपस्थिति में, मेथनॉल सीएच 3 ओएच सीधे मीथेन से प्राप्त किया जा सकता है, और सीओ अणुओं से जुड़े रोडियम आरएच [(सी 6 एच 5) 3 पी] के ट्राइफेनिलफॉस्फिन कॉम्प्लेक्स की उपस्थिति में; प्रतिक्रिया के दौरान, सीओ अणुओं को एल्डीहाइड बनाने के लिए अल्केन्स के सी-एच बांड में पेश किया जाता है।
साइक्लोअल्केन्स में अल्केन्स के समान रासायनिक गुण होते हैं। इस प्रकार, वे ज्वलनशील होते हैं, एक कट्टरपंथी तंत्र द्वारा हलोजन किया जा सकता है, और उत्प्रेरक की उपस्थिति में ऊंचे तापमान पर वे निर्जलित होते हैं - वे हाइड्रोजन को विभाजित करते हैं और असंतृप्त हाइड्रोकार्बन में बदल जाते हैं। जैसा कि बताया गया है, साइक्लोप्रोपेन में विशेष गुण होते हैं। अल्केन्स के विपरीत, साइक्लोअल्केन्स हाइड्रोजनीकृत होते हैं, जब रिंग खुलती है और अल्केन्स बनते हैं, उदाहरण के लिए: साइक्लो-सी 3 एच 6 + एच 2 ® सी 3 एच 8 (प्लैटिनम उत्प्रेरक की उपस्थिति में गर्म करने पर प्रतिक्रिया होती है)। जैसे-जैसे चक्र का आकार बढ़ता है, प्रतिक्रिया अधिक कठिन होती जाती है - इस प्रकार, साइक्लोपेंटेन पहले से ही बड़ी कठिनाई से और उच्च तापमान (300 डिग्री सेल्सियस) पर हाइड्रोजनीकृत (पेंटेन में) हो जाता है।
प्रकृति में रहना और प्राप्त करना।
अल्केन्स के मुख्य स्रोत तेल और प्राकृतिक गैस हैं। मीथेन प्राकृतिक गैस का बड़ा हिस्सा है; इसमें थोड़ी मात्रा में ईथेन, प्रोपेन और ब्यूटेन भी होते हैं। मीथेन दलदलों और कोयला परतों से उत्सर्जन में पाया जाता है। हल्के समरूपों के साथ, मीथेन संबंधित पेट्रोलियम गैसों में मौजूद है। ये गैसें दबाव में तेल में घुल जाती हैं और इसके ऊपर भी स्थित होती हैं। अल्केन्स पेट्रोलियम उत्पादों का एक महत्वपूर्ण हिस्सा बनाते हैं। तेल में साइक्लोअल्केन्स भी होते हैं - इन्हें नैफ्थीन (ग्रीक से) कहा जाता है। मिट्टी का तेल- तेल)। अल्केन्स के गैस हाइड्रेट्स, मुख्य रूप से मीथेन, भी प्रकृति में व्यापक हैं; वे महाद्वीपों पर और महासागरों के तल पर तलछटी चट्टानों में पाए जाते हैं। उनका भंडार संभवतः प्राकृतिक गैस के ज्ञात भंडार से अधिक है और भविष्य में मीथेन और इसके निकटतम समरूपों का स्रोत बन सकता है।
कोयले के पायरोलिसिस (कोकिंग) और उसके हाइड्रोजनीकरण (सिंथेटिक तरल ईंधन का उत्पादन) से भी अल्केन्स प्राप्त होते हैं। ठोस अल्केन्स प्रकृति में पहाड़ी मोम - ओज़ोकेराइट के जमाव के रूप में पत्तियों, फूलों और पौधों के बीजों की मोमी कोटिंग में पाए जाते हैं, और मधुमक्खी के मोम का हिस्सा होते हैं।
उद्योग में, कार्बन ऑक्साइड सीओ और सीओ 2 (फिशर-ट्रॉप्स विधि) के उत्प्रेरक हाइड्रोजनीकरण द्वारा अल्केन्स का उत्पादन किया जाता है। प्रयोगशाला में, मीथेन को ठोस क्षार के साथ सोडियम एसीटेट को गर्म करके प्राप्त किया जा सकता है: CH 3 COONa + NaOH ® CH 4 + Na 2 CO 3, साथ ही कुछ कार्बाइड के हाइड्रोलिसिस द्वारा: Al 4 C 3 + 12H 2 O ® 3CH 4 + 4Al(OH) 3 . मिथेन के समजात वुर्ट्ज़ प्रतिक्रिया द्वारा प्राप्त किए जा सकते हैं, उदाहरण के लिए: 2CH 3 Br + 2Na ® CH 3 –CH 3 + 2NaBr। डाइहैलोऐल्केन के मामले में, साइक्लोऐल्केन प्राप्त होते हैं, उदाहरण के लिए: Br-CH 2 -(CH 2) 4 -CH 2 Br + 2Na ® साइक्लो-सी 6 एच 12 + 2एनएबीआर। एल्केन्स का निर्माण कार्बोक्जिलिक एसिड के डीकार्बाक्सिलेशन और उनके इलेक्ट्रोलिसिस के दौरान भी होता है।
अल्केन्स का अनुप्रयोग.
गैसोलीन, केरोसिन, डीजल तेल और ईंधन तेल में अल्केन्स का उपयोग ईंधन के रूप में किया जाता है। उच्च एल्केन्स चिकनाई वाले तेल, पेट्रोलियम जेली और पैराफिन में पाए जाते हैं। आइसोमेरिक पेंटेन और हेक्सेन के मिश्रण को पेट्रोलियम ईथर कहा जाता है और इसका उपयोग विलायक के रूप में किया जाता है। साइक्लोहेक्सेन का उपयोग विलायक के रूप में और पॉलिमर (नायलॉन, नायलॉन) के संश्लेषण के लिए भी व्यापक रूप से किया जाता है। साइक्लोप्रोपेन का उपयोग एनेस्थीसिया के लिए किया जाता है। स्क्वालेन एक उच्च गुणवत्ता वाला चिकनाई वाला तेल है, जो फार्मास्युटिकल और कॉस्मेटिक तैयारियों का एक घटक है, और गैस-तरल क्रोमैटोग्राफी में एक अवशोषक है।
अल्केन्स अल्कोहल, एल्डिहाइड और एसिड सहित कई कार्बनिक यौगिकों के उत्पादन के लिए कच्चे माल के रूप में काम करते हैं। अल्केन्स के क्लोरीन डेरिवेटिव का उपयोग सॉल्वैंट्स के रूप में किया जाता है, उदाहरण के लिए, ट्राइक्लोरोमेथेन (क्लोरोफॉर्म) सीएचसीएल 3, कार्बन टेट्राक्लोराइड सीसीएल 4। उच्च अल्केन्स का मिश्रण - पैराफिन गैर विषैला होता है और खाद्य उद्योग में कंटेनरों और पैकेजिंग सामग्री (उदाहरण के लिए, दूध के डिब्बों) के संसेचन और च्यूइंग गम के उत्पादन में व्यापक रूप से उपयोग किया जाता है। बेहतर जलने के लिए पेंसिल और माचिस के ऊपरी (सिर के पास) हिस्से को पैराफिन से भिगोया जाता है। गर्म पैराफिन का उपयोग औषधीय प्रयोजनों (पैराफिन उपचार) के लिए किया जाता है। उत्प्रेरक (कार्बनिक संक्रमण धातु लवण) की उपस्थिति में नियंत्रित परिस्थितियों में पैराफिन के ऑक्सीकरण से ऑक्सीजन युक्त उत्पादों, मुख्य रूप से कार्बनिक अम्ल का उत्पादन होता है।
इल्या लीनसन
साहित्य:
पेत्रोव ए.ए. अल्केन्स की रसायन शास्त्र. एम., नौका, 1974
अज़रबायेव आई.एन. और आदि। पेट्रोलियम हाइड्रोकार्बन पर आधारित संश्लेषण. अल्मा-अता, विज्ञान, 1974
रुदाकोव ई.एस. ऑक्सीकरण एजेंटों, धातु परिसरों और समाधानों में रेडिकल के साथ अल्केन्स की प्रतिक्रियाएं. कीव, नौकोवा दुमका, 1985
परौसानु वी. हाइड्रोकार्बन का उत्पादन और उपयोग. एम., रसायन विज्ञान, 1987