Alkaner kort. Alkaner: kemiska egenskaper
Fysikaliska egenskaper hos alkaner
Under normala förhållanden är de första fyra medlemmarna av den homologa serien av alkaner (C 1 - C 4) gaser. Normala alkaner från pentan till heptadekan (C 5 - C 17) är vätskor, från C 18 och uppåt är fasta ämnen. När antalet kolatomer i kedjan ökar, d.v.s. När den relativa molekylvikten ökar ökar alkanernas kok- och smältpunkter.
Med samma antal kolatomer i molekylen har grenade alkaner lägre kokpunkter än normala alkaner.
Alkaner är praktiskt taget olösliga i vatten, eftersom deras molekyler är lågpolära och interagerar inte med vattenmolekyler. Flytande alkaner blandas lätt med varandra. De löser sig väl i opolära organiska lösningsmedel som bensen, koltetraklorid, etc.
Strukturera
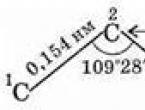
Molekylen av den enklaste alkanen - metan - har formen av en vanlig tetraeder, i mitten av vilken det finns en kolatom, och vid hörnen finns det väteatomer. Vinklarna mellan axlarna för C-H-bindningarna är 109°28" (Fig. 29).
I molekyler av andra mättade kolväten har vinklarna mellan bindningar (både C-H och C-C) samma betydelse. För att beskriva formen på molekyler används begreppet hybridisering av atomära orbitaler(se del I, §6).
I alkaner finns alla kolatomer i tillståndet sp 3 - hybridisering (Fig. 30).
Således är kolatomerna i kolkedjan inte i en rak linje. Avståndet mellan angränsande kolatomer (mellan atomernas kärnor) är strikt fixat - det är kemisk bindningslängd(0,154 nm). Avstånd C 1 - C 3, C 2 - C 4, etc. (genom en atom) är också konstanta, eftersom vinkeln mellan bindningarna är konstant - bindningsvinkel.

Avstånden mellan mer avlägsna kolatomer kan förändras (inom vissa gränser) som ett resultat av rotation kring s-bindningar. Denna rotation stör inte överlappningen av orbitalerna som bildar s-bindningen, eftersom denna bindning har axiell symmetri.


Olika rumsliga former av en molekyl som bildas genom rotation av grupper av atomer runt s-bindningar kallas konformationer(Fig. 31).
Konformationer skiljer sig i energi, men denna skillnad är liten (12-15 kJ/mol). Konformationer av alkaner där atomerna är placerade så långt ifrån varandra som möjligt är mer stabila (repulsion av elektronskal). Övergången från en konformation till en annan utförs på grund av energin från termisk rörelse. För att avbilda konformationen används speciella rumsliga formler (Newmans formler).
Var inte förvirrad!
Det är nödvändigt att skilja mellan begreppen konformation och konfiguration.
Olika konformationer kan omvandlas till varandra utan att bryta kemiska bindningar. För att omvandla en molekyl med en konfiguration till en molekyl med en annan konfiguration krävs att kemiska bindningar bryts.
Av fyra typer isomeri Alkaner kännetecknas av två: isomerism av kolskelettet och optisk isomerism (se del
Kemiska bindningar i alkaner, deras brytning och bildning bestämmer de kemiska egenskaperna hos alkaner. C-C och CH-bindningar är kovalenta, enkla (s-bindningar), praktiskt taget opolära, ganska starka, därför:
1) alkaner ingår oftast i reaktioner som involverar hemolytisk klyvning av bindningar;
2) jämfört med organiska föreningar av andra klasser har alkaner låg reaktivitet (för detta kallas de paraffiner- "beroende på egenskaper"). Sålunda är alkaner resistenta mot verkan av vattenlösningar av syror, alkalier och oxidationsmedel (till exempel kaliumpermanganat) även när de kokas.
Alkaner reagerar inte med tillsats av andra molekyler till dem, eftersom Alkaner har inte flera bindningar i sina molekyler.
Alkaner genomgår sönderdelning under stark uppvärmning i närvaro av katalysatorer i form av platina eller nickel, och väte elimineras från alkanerna.
Alkaner kan genomgå isomeriseringsreaktioner. Deras typiska reaktion är substitutionsreaktion, genom en radikal mekanism.
Kemiska egenskaper
Radikala förskjutningsreaktioner
Som ett exempel, överväg interaktion mellan alkaner och halogener. Fluor reagerar mycket kraftigt (vanligtvis med en explosion) - i detta fall bryts alla CH- och C-C-bindningar, och som ett resultat bildas CF 4- och HF-föreningar. Reaktionen har ingen praktisk betydelse. Jod interagerar inte med alkaner. Reaktioner med klor eller brom sker antingen med ljus eller med stark värme; i detta fall sker bildningen av mono- till polyhalogen-substituerade alkaner, till exempel:
CH3-CH3+Cl2® hv CH3-CH2-Cl+HCl
Bildandet av metanhalogenderivat fortskrider genom en kedja fria radikaler mekanism. Under påverkan av ljus bryts klormolekyler ner till oorganiska radikaler:
Oorganisk radikal Cl. abstraherar en väteatom med en elektron från en metanmolekyl och bildar HC1 och den fria radikalen CH3
![]()
Den fria radikalen interagerar med Cl 2 klormolekylen och bildar ett halogenderivat och en klorradikal.
![]()
Oxidationsreaktionen börjar med utvinningen av en väteatom av en syremolekyl (som är en diradikal) och fortsätter sedan som en grenad kedjereaktion. Antalet radikaler ökar under reaktionen. Processen åtföljs
genom att frigöra en stor mängd värme bryts inte bara C-H-bindningarna, utan även C-C-bindningarna, så att som ett resultat bildas kolmonoxid (IV) och vatten. Reaktionen kan fortgå som förbränning eller leda till en explosion.
2С n Н2 n+2 +(3n+1)О 2 ®2nСО 2 +(2n+2)Н 2 O
Vid vanliga temperaturer inträffar inte oxidationsreaktionen; den kan initieras antingen genom tändning eller genom elektrisk urladdning.
Vid kraftig uppvärmning (över 1000°C) sönderfaller alkaner fullständigt till kol och väte. Denna reaktion kallas pyrolys.
CH4® 1200°C+2H 2
Genom mild oxidation av alkaner, i synnerhet metan, med atmosfäriskt syre i närvaro av olika katalysatorer kan metylalkohol, formaldehyd och myrsyra erhållas.

Om metan leds genom en uppvärmd zon mycket snabbt och sedan omedelbart kyls med vatten, blir resultatet acetylen.
Denna reaktion är grunden för en industriell syntes som kallas krackning(ofullständig nedbrytning) av metan.
Krackning av metanhomologer utförs vid en lägre temperatur (ca 600°C). Till exempel inkluderar propansprickning följande steg:

Så, krackning av alkaner leder till bildandet av en blandning av alkaner och alkener med lägre molekylvikt.
Uppvärmning av alkaner till 300-350°C (sprickbildning har ännu inte inträffat) i närvaro av en katalysator (Pt eller Ni) leder till dehydrering- avlägsnande av väte.

När utspädd salpetersyra verkar på alkaner vid 140°C och lågt tryck uppstår en radikalreaktion:
CH3-CH3 + HNO3®CH3-CH2-NO2 + H2O Isomerisering
Under vissa förhållanden kan normala alkaner omvandlas till grenkedjiga alkaner.
Framställning av alkaner
Låt oss överväga produktionen av alkaner med hjälp av exemplet med metanproduktion. Metan är utbrett i naturen. Det är huvudkomponenten i många brandfarliga gaser, både naturliga (90-98%) och konstgjorda, som frigörs under torrdestillation av trä, torv, kol, såväl som under oljekrackning. Naturgaser, särskilt associerade gaser från oljefält, innehåller förutom metan etan, propan, butan och pentan.
Metan frigörs från botten av träsk och från kollag i gruvor, där det bildas under långsam nedbrytning av växtrester utan tillgång till luft. Därför kallas metan ofta för träskgas eller brandgas.
I laboratoriet produceras metan genom att värma upp en blandning av natriumacetat och natriumhydroxid:
CH3COONa+NaOH® 200 ° Na2CO3 +CH4
eller när aluminiumkarbid interagerar med vatten: Al 4 Cl 3 +12H 2 O®4Al(OH) 3 +3CH 4
I det senare fallet visar sig metanet vara mycket rent.
Metan kan framställas av enkla ämnen genom uppvärmning i närvaro av en katalysator:
C+2H 2 ® Ni CH 4 8 också genom syntes baserad på vattengas
CO+3H2® Ni CH4+H2O
Denna metod är av industriell betydelse. Vanligtvis används dock metan från naturgaser eller gaser som bildas vid koksning av kol och vid oljeraffinering.
Homologer av metan, liksom metan, erhålls under laboratorieförhållanden genom kalcinering av salter av motsvarande organiska syror med alkalier. En annan metod är Wurtz-reaktionen, dvs. uppvärmning av monohalogenderivat med natriummetall, till exempel:
C2H5Br+2Na+BrC2H6® C2H5-C2H5 +2NaBr
Inom tekniken används syntes för att producera teknisk bensin (en blandning av kolväten innehållande 6-10 kolatomer).
från kolmonoxid (II) och väte i närvaro av en katalysator (koboltförening) och vid förhöjt tryck. Bearbeta
kan uttryckas med ekvationen
nСО+(2n+1)Н 2 ® 200° C n H 2n+2 +nН 2 O
Så de huvudsakliga källorna till alkaner är naturgas och olja. Vissa mättade kolväten syntetiseras dock från andra föreningar.
Tillämpningar av alkaner
De flesta alkaner används som bränsle. Sprickbildning och
Deras dehydrering leder till omättade kolväten, vilket
från vilka många andra organiska ämnen erhålls.
Metan är huvuddelen av naturgaser (60-99%). Del
naturgaser inkluderar propan och butan. Flytande kolväten
används som bränsle i förbränningsmotorer, bilar, flygplan etc. En renad blandning av vätska
och fasta alkaner bildar vaselin. Högre alkaner är
utgångsmaterial för tillverkning av syntetiska tvättmedel. Alkaner som erhålls genom isomerisering används vid tillverkning av högkvalitativ bensin och gummi. Nedan visas ett diagram över användningen av metan

Cykloalkaner
Strukturera
Cykloalkaner är mättade kolväten vars molekyler innehåller en sluten ring av kolatomer.
Cykloalkaner (cykloparaffiner) bildar en homolog serie med den allmänna formeln C n H 2 n, där den första medlemmen är
cyklopropan C3H6, eftersom För att bilda en ring måste minst tre kolatomer vara närvarande.
Cykloalkaner har flera namn: cykloparaffiner, naftener, cyklaner, polymetylener. Exempel på några kopplingar:

Formeln CnH2n är karakteristisk för cykloparaffiner, och exakt samma formel beskriver den homologa serien av alkener (omättade kolväten med en multipelbindning). Av detta kan vi dra slutsatsen att varje cykloalkan är isomer med en motsvarande alken - detta är ett exempel på "interklassisk" isomerism.
Cykloalkaner delas in i ett antal grupper baserat på ringstorlek, av vilka vi kommer att överväga två: små (C 3, C 4) och vanliga (C 5 -C 7) cykler.
Namnen på cykloalkaner konstrueras genom att lägga till prefixet cyklo- till namnet på alkanen med motsvarande antal kolatomer. Numreringen i cykeln utförs så att substituenterna får de lägsta talen.
Strukturformler för cykloalkaner skrivs vanligtvis i förkortad form, med hjälp av ringens geometriska form och utelämnar symbolerna för kol- och väteatomerna. Till exempel:

Den strukturella isomerismen av cykloalkaner bestäms av storleken på ringen (cyklobutan och metylcyklopropan är isomerer) och placeringen av substituenterna i ringen (till exempel 1,1- och 1,2-dimetylbutan), såväl som deras struktur .
Rumslig isomerism är också karakteristisk för cykloalkaner, eftersom den är associerad med olika arrangemang av substituenter i förhållande till ringplanet. När substituenter placeras på ena sidan av ringplanet erhålls cis-isomerer och trans-isomerer på motsatta sidor.
Mättade kolväten- dessa är kolväten vars molekyler endast innehåller enkla (enkel)bindningar (-bindningar). Mättade kolväten är alkaner och cykloalkaner.
Kolatomerna i mättade kolväten är i ett tillstånd av sp 3 hybridisering.
Alkaner- mättade kolväten, vars sammansättning uttrycks av den allmänna formeln C n H 2n+2. Alkaner är mättade kolväten.
Isomerer och homologer
| G | CH 4 metan |
||||
| CH3-CH3 etan |
|||||
| CH3-CH2-CH3 propan |
|||||
| CH 3 — (CH 2) 2 — CH 3 butan |
2-metylpropan |
||||
| CH 3 — (CH 2) 3 — CH 3 pentan |
2-metylbutan |
2,2-dimetylpropan |
|||
| CH 3 — (CH 2) 4 — CH 3 hexan |
2-metylpentan |
2,2-dimetylbutan |
2,3-dimetylbutan |
3-metylpentan |
|
| isomerer | |||||
Fysikaliska egenskaper hos alkaner
Vid rumstemperatur är C1-C4 gaser, C5-C15 är vätskor, C16 och följande är fasta ämnen; olöslig i vatten; densitet mindre än 1 g/cm3; vätska - med lukten av bensin.
När antalet kolatomer i en molekyl ökar, ökar kokpunkten.
Kemiska egenskaper hos alkaner
Låg aktivitet under normala förhållanden, reagerar inte med lösningar av syror och alkalier, missfärga inte KMnO 4-lösning och bromvatten.
>Framställning av alkaner
>>Cykloalkaner- mättade kolväten, vars sammansättning uttrycks med formeln C n H 2 n. Cykloalkanmolekyler innehåller slutna kolkedjor (cykler).
Isomerer och homologer
| G | Cyklopropan C3H6 eller |
||||
| Cyklobutan C4H8 eller |
Metylcyklopropan |
||||
| Cyklopentan C 5 H 10 eller |
Metylcyklobutan |
1,1-dimetylcyklopropan |
1,2-dimetylcyklopropan |
Etylcyklopropan |
|
| isomerer | |||||
Förenklat är kolvätecykeln ofta avbildad som en vanlig polygon med lämpligt antal vinklar.
Fysikaliska egenskaper skiljer sig lite från de hos alkaner.
Kemiska egenskaper
Med undantag för cyklopropan och cyklobutan är cykloalkaner, liksom alkaner, inaktiva under normala förhållanden.
Allmänna egenskaper hos cykloalkaner (med cyklohexan som exempel):
>Speciella egenskaper hos cyklopropan och cyklobutan (benägenhet för additionsreaktioner):
Metoder för att erhålla cykloalkaner
Algoritm för att sammanställa namn på mättade kolväten
- Hitta kolets ryggrad: det är den längsta kedjan av kolatomer.
- Numrera kolatomerna i huvudkedjan, börja med änden närmast grenen.
- Ange numret på kolatomen i huvudkedjan som har en substituent och ange namnet på substituenten. Om det finns flera substituenter, ordna dem alfabetiskt. Innan namnen på identiska substituenter, ange numren på alla kolatomer som de är bundna till och använd multiplicerande prefix (di-, tri-, tetra-).
- Skriv namnet på huvudkedjan med suffixet -an. Rötterna till huvudkedjans namn: C 1 - met, C 2 - et, C 3 - prop, C 4 - men, C 5 - pent, C 6 - hex, C 7 - hep, C 8 - okt, C 9 - icke, Från 10 - dec. Namnen på osubstituerade cykloalkaner bildas av namnet på det mättade kolvätet med tillägg av prefixet cyklo-. Om det finns substituenter i en cykloalkan, så är kolatomerna i ringen numrerade från den enklaste substituenten (den äldsta, metyl) till den mer komplexa på det kortaste sättet, och substituenternas positioner anges på samma sätt som i alkaner.
Uppgifter och tester på ämnet "Ämne 1. "Mättade kolväten"."
- Kolväten. Polymerer - Organiska ämnen grad 8–9
Lektioner: 7 uppgifter: 9 prov: 1
- - Människan i ämnens, material och kemiska reaktioners värld, årskurs 8–9
Lektioner: 2 uppgifter: 6 prov: 1
- Klassificering av ämnen - Klasser av oorganiska ämnen grad 8–9
Lektioner: 2 uppgifter: 9 prov: 1
A. Med tanke på egenskaperna hos ett ämne som deltar i reaktionen (massa, volym, mängd ämne), måste du hitta egenskaperna hos ett annat ämne.Exempel. Bestäm mängden klor som krävs för det första kloreringssteget av 11,2 liter metan.
Svar: m(Cl2) = 35,5 g.
B. Beräkningar med hjälp av regeln för volymförhållanden för gaser.
Exempel. Bestäm vilken volym syre, mätt under normala förhållanden (n.o.), som krävs för fullständig förbränning av 10 m 3 propan (n.o.).
Svar: V(O 2) = 50 m 3.Efter att ha sett till att allt du behöver har bemästrats, fortsätt till att slutföra uppgifterna för ämne 1. Vi önskar dig framgång.
Rekommenderad läsning:- O. S. Gabrielyan med flera. Kemi 10:e klass. M., Bustard, 2002;
- L.S. Guzey, R.P. Surovtseva, G.G. Lysova. Kemi årskurs 11. Bustard, 1999.
- G.G. Lysova. Grundläggande anteckningar och prov i organisk kemi. M., Glik Plus LLC, 1999.
Mättade kolväten är föreningar som är molekyler som består av kolatomer i ett tillstånd av sp 3 hybridisering. De är anslutna till varandra uteslutande genom kovalenta sigmabindningar. Namnet "mättade" eller "mättade" kolväten kommer från det faktum att dessa föreningar inte har förmågan att fästa några atomer. De är extrema, helt mättade. Undantaget är cykloalkaner.
Vad är alkaner?
Alkaner är mättade kolväten, och deras kolkedja är öppen och består av kolatomer anslutna till varandra med hjälp av enkelbindningar. Den innehåller inte andra (det vill säga dubbelbindningar som alkener eller trippelbindningar som alkyler). Alkaner kallas också paraffiner. De fick detta namn eftersom välkända paraffiner är en blandning av övervägande dessa mättade kolväten C 18 - C 35 med speciell inerthet.
Allmän information om alkaner och deras radikaler
Deras formel: C n P 2 n +2, här är n större än eller lika med 1. Molmassan beräknas med formeln: M = 14n + 2. Karakteristiskt särdrag: ändelserna i deras namn är "-an". Resterna av deras molekyler, som bildas som ett resultat av att väteatomer ersätts med andra atomer, kallas alifatiska radikaler eller alkyler. De betecknas med bokstaven R. Den allmänna formeln för envärda alifatiska radikaler: C n P 2 n +1, här är n större än eller lika med 1. Molmassan för alifatiska radikaler beräknas med formeln: M = 14n + 1. Ett karakteristiskt drag för alifatiska radikaler: ändelser i namnen "- silt." Alkanmolekyler har sina egna strukturella egenskaper:
- C-C-bindningen kännetecknas av en längd av 0,154 nm;
- CH-bindningen kännetecknas av en längd av 0,109 nm;
- bindningsvinkeln (vinkeln mellan kol-kolbindningar) är 109 grader och 28 minuter.

Alkaner börjar den homologa serien: metan, etan, propan, butan och så vidare.
Fysikaliska egenskaper hos alkaner
Alkaner är ämnen som är färglösa och olösliga i vatten. Temperaturen vid vilken alkaner börjar smälta och temperaturen vid vilken de kokar ökar i enlighet med ökningen av molekylvikt och kolvätekedjelängd. Från mindre grenade till mer grenade alkaner minskar kokpunkten och smältpunkten. Gasformiga alkaner kan brinna med en ljusblå eller färglös låga och producera ganska mycket värme. CH 4 -C 4 H 10 är gaser som inte heller har någon lukt. C 5 H 12 - C 15 H 32 är vätskor som har en specifik lukt. C 15 H 32 och så vidare är fasta ämnen som också är luktfria.
Kemiska egenskaper hos alkaner
Dessa föreningar är kemiskt inaktiva, vilket kan förklaras av styrkan hos svårbrytbara sigmabindningar - C-C och C-H. Det är också värt att tänka på att C-C-bindningar är opolära och C-H-bindningar är lågpolära. Dessa är lågpolariserade typer av bindningar som tillhör sigma-typen och följaktligen kommer de med största sannolikhet att brytas av en homolytisk mekanism, som ett resultat av vilket radikaler kommer att bildas. Således är de kemiska egenskaperna hos alkaner huvudsakligen begränsade till radikala substitutionsreaktioner.

Nitreringsreaktioner
Alkaner reagerar endast med salpetersyra med en koncentration av 10% eller med fyrvärd kväveoxid i en gasformig miljö vid en temperatur av 140°C. Nitreringsreaktionen av alkaner kallas Konovalov-reaktionen. Som ett resultat bildas nitroföreningar och vatten: CH 4 + salpetersyra (utspädd) = CH 3 - NO 2 (nitrometan) + vatten.
Förbränningsreaktioner
Mättade kolväten används mycket ofta som bränsle, vilket motiveras av deras förmåga att förbränna: C n P 2n+2 + ((3n+1)/2) O 2 = (n+1) H 2 O + n CO 2.
Oxidationsreaktioner
Alkanernas kemiska egenskaper inkluderar även deras förmåga att oxidera. Beroende på vilka förhållanden som följer med reaktionen och hur de ändras, kan olika slutprodukter erhållas från samma ämne. Mild oxidation av metan med syre i närvaro av en katalysator som accelererar reaktionen och en temperatur på cirka 200 ° C kan resultera i följande ämnen:
1) 2CH4 (oxidation med syre) = 2CH3OH (alkohol - metanol).
2) CH 4 (oxidation med syre) = CH 2 O (aldehyd - metanal eller formaldehyd) + H 2 O.
3) 2CH 4 (oxidation med syre) = 2HCOOH (karboxylsyra - metan eller myrsyra) + 2H 2 O.

Oxidationen av alkaner kan också utföras i ett gasformigt eller flytande medium med luft. Sådana reaktioner leder till bildning av högre fettalkoholer och motsvarande syror.
Förhållande till värme
Vid temperaturer som inte överstiger +150-250°C, alltid i närvaro av en katalysator, inträffar en strukturell omarrangering av organiska ämnen, som består av en förändring i ordningsföljden för anslutningen av atomer. Denna process kallas isomerisering, och de ämnen som blir resultatet av reaktionen kallas isomerer. Från normal butan erhålls alltså dess isomer - isobutan. Vid temperaturer på 300-600°C och närvaron av en katalysator bryts C-H-bindningar med bildandet av vätemolekyler (dehydreringsreaktioner), vätemolekyler med stängning av kolkedjan i en cykel (cykliserings- eller aromatiseringsreaktioner av alkaner) :
1) 2CH4 = C2H4 (eten) + 2H2.
2) 2CH4 = C2H2 (etyn) + 3H2.
3) C7H16 (normal heptan) = C6H5 - CH3 (toluen) + 4 H2.

Halogeneringsreaktioner
Sådana reaktioner involverar införandet av halogener (deras atomer) i molekylen av ett organiskt ämne, vilket resulterar i bildandet av en C-halogenbindning. När alkaner reagerar med halogener bildas halogenderivat. Denna reaktion har specifika egenskaper. Det fortsätter enligt en radikal mekanism, och för att initiera det är det nödvändigt att utsätta blandningen av halogener och alkaner för ultraviolett strålning eller helt enkelt värma den. Alkanernas egenskaper tillåter halogeneringsreaktionen att fortgå tills fullständig ersättning med halogenatomer uppnås. Det vill säga, kloreringen av metan kommer inte att sluta i ett steg och produktionen av metylklorid. Reaktionen kommer att gå längre, alla möjliga substitutionsprodukter kommer att bildas, som börjar med klormetan och slutar med koltetraklorid. Exponering av andra alkaner för klor under dessa förhållanden kommer att resultera i bildning av olika produkter som ett resultat av substitution av väte vid olika kolatomer. Temperaturen vid vilken reaktionen sker bestämmer förhållandet mellan slutprodukterna och hastigheten för deras bildning. Ju längre kolvätekedjan i alkanen är, desto lättare blir reaktionen. Under halogeneringen kommer den minst hydrerade (tertiära) kolatomen att ersättas först. Den primära kommer att reagera efter alla de andra. Halogeneringsreaktionen kommer att ske i steg. I det första steget ersätts endast en väteatom. Alkaner interagerar inte med halogenlösningar (klor och bromvatten).

Sulfokloreringsreaktioner
De kemiska egenskaperna hos alkaner kompletteras också av sulfokloreringsreaktionen (kallad Reed-reaktionen). När de utsätts för ultraviolett strålning kan alkaner reagera med en blandning av klor och svaveldioxid. Som ett resultat bildas väteklorid, liksom en alkylradikal, som tillför svaveldioxid. Resultatet är en komplex förening som blir stabil på grund av infångningen av en kloratom och förstörelsen av dess nästa molekyl: R-H + SO 2 + Cl 2 + ultraviolett strålning = R-SO 2 Cl + HCl. Sulfonylkloriderna som bildas som ett resultat av reaktionen används i stor utsträckning vid framställning av ytaktiva ämnen.
Alkaner erhålls från petroleumprodukter, naturgas och kol. Den huvudsakliga användningen av alkaner är som bränsle. Ämnena används också för att göra lösningsmedel, kosmetika och asfalt.
Beskrivning
Alkaner är en klass av mättade eller mättade kolväten. Det betyder att alkanmolekyler innehåller det maximala antalet väteatomer. Den allmänna formeln för föreningar av den homologa serien av alkaner är CnH2n+2. Namnen på ämnen är sammansatta av de grekiska siffrorna och suffixet -an.
De fysikaliska och kemiska egenskaperna hos alkaner beror på deras struktur. När antalet kolatomer i en molekyl ökar sker en övergång från gasformiga ämnen till fasta föreningar.
Det fysiska tillståndet för alkaner beroende på antalet kolatomer:
- C1-C4- gaser;
- Från 5 till 15- vätskor;
- Från 16 - Från 390- fasta ämnen.
Gaser brinner med en blå låga och frigör en stor mängd värme. Alkaner som innehåller 18-35 kolatomer är vaxartade, mjuka ämnen. Paraffinljus är gjorda av deras blandning.

Ris. 1. Paraffinljus.
Med ökande molekylvikt i den homologa serien ökar smält- och kokpunkterna.
Ansökan
Alkaner är isolerade från mineraler - olja, gas, kol. I olika stadier av bearbetningen erhålls bensin, fotogen och eldningsolja. Alkaner används inom medicin, kosmetologi och konstruktion.

Ris. 2. Olja innehåller flytande alkaner.
Tabellen beskriver de huvudsakliga användningsområdena för mättade kolväten.
|
Område |
Vad används |
Hur man använder |
|
Energiindustrin |
Bensin, fotogen, eldningsolja |
Som raket och motorbränsle |
|
Gasformiga alkaner |
Som hushållsgas för matlagning |
|
|
Kemisk industri |
Petroleumeter (en blandning av isopentaner och isohexaner), |
Tillverkning av lösningsmedel, smörjoljor, impregnering |
|
Framställning av vaselin (en blandning av flytande alkaner), vaselin (en blandning av flytande och fasta alkaner), ljus, rengöringsmedel, fernissor, emaljer, tvål. Som impregnering för tändstickor. Används vid framställning av organiska syror |
||
|
Klorerade alkaner |
Produktion av alkoholer, aldehyder, syror |
|
|
Kosmetologi |
Vaselin, vaselin |
Tillverkning av salvor |
|
Som drivmedel för tillverkning av aerosoler |
||
|
Tillverkning av fuktgivande kosmetika |
||
|
Konstruktion |
Tjära (tjära) är slutprodukten från oljeraffinering, som innehåller en blandning av alkaner, cykloalkaner, arener, metaller, icke-metaller |
För tillverkning av asfaltvägar |
|
Pappers- och massaindustrin |
Som impregnering för förpackningspapper |
|
|
Livsmedelsindustrin |
Tuggummiproduktion |

Ris. 3. Tjära.
Alkaner används vid tillverkning av gummi, syntetiska tyger, plaster och ytaktiva ämnen. Propan och butan i flytande form används för att fylla på brandsläckningsflaskor.
Vad har vi lärt oss?
Vi lärde oss kort om användningen av alkaner. Mättade kolväten i gasformiga, flytande och fasta tillstånd används inom kemi-, livsmedels-, pappers-, energiindustrin, kosmetologi och konstruktion. Alkaner används för att producera lösningsmedel, färger, lacker, tvålar, ljus, salvor och asfalt. Bensin, fotogen och eldningsolja, bestående av flytande alkaner, används som bränsle. Gasformiga alkaner används i vardagen och för framställning av aerosoler. De huvudsakliga källorna till alkaner är olja, naturgas och kol.
Innehållet i artikeln
ALKANER OCH CYKLOALKANER– kolväten där alla kolatomer är förbundna med varandra och till väteatomer genom enkla (enkel)bindningar. Alkaner (synonymer - mättade kolväten, mättade kolväten, paraffiner) - kolväten med den allmänna formeln C n H 2 n+2, var n– antal kolatomer. Den välbekanta polyetenen har samma formel, bara storleken n den är mycket stor och kan nå tiotusentals. Dessutom innehåller polyeten molekyler av olika längd. I cykloalkaner bildar kolatomerna en sluten kedja; om det finns en cykel är formeln för cykloalkanen C n H 2 n .
Beroende på kopplingsordningen för kolatomer i en kedja delas alkaner in i linjära och grenade. Följaktligen för alkaner med nі 4 det är möjligt att det finns mer än ett ämne med samma formel. Sådana ämnen kallas isomerer (från grekiskan. isis– lika, identisk och meros – andel, del.
Namn på alkaner.
Ordet "alkan" är av samma ursprung som "alkohol" ( se nedan). Den föråldrade termen "paraffin" kommer från latinets parum - litet, obetydligt och affinis - relaterat; paraffiner har låg reaktivitet med avseende på de flesta kemiska reagenser. Många paraffiner är homologer; i den homologa serien av alkaner skiljer sig varje efterföljande medlem från den föregående efter en metylengrupp CH2. Termen kommer från det grekiska homologos - motsvarande, liknande.
Nomenklatur (från lat. nomenklatur– namnlista) är namnen på alkaner konstruerade enligt vissa regler, som inte alltid är entydiga. Så, om det finns olika substituenter i en alkanmolekyl, är de listade i alfabetisk ordning i alkanens namn. Denna ordning kan dock variera på olika språk. Till exempel kommer kolvätet CH 3 –CH(CH 3) – CH(C 2 H 5) – CH 2 – CH 2 – CH 3 i enlighet med denna regel att kallas 2-metyl-3-etylhexan på ryska, och i Engelsk 3-etyl-2-metylhexan...
I enlighet med namnet på kolvätet kallas alkylradikaler också: metyl (CH 3 -), etyl (C 2 H 5 -), isopropyl (CH 3) 2 CH-, tis-butyl C2H5-CH (CH3)-, gnuggar-butyl (CH3)3C-, etc. Alkylradikaler ingår som en helhet i sammansättningen av många organiska föreningar; i fritt tillstånd är dessa partiklar med en oparad elektron extremt aktiva.
Vissa isomerer av alkaner har också triviala namn ( centimeter. TRIVIELLA ÄMNESNAMN, t ex isobutan (2-metylpropan), isooktan (2,2,4-trimetylpentan), neopentan (2,3-dimetylpropan), skvalan (2,6,10,15,19,23-hexametyltetrakosan), vars namn kommer från latin squalus– haj (ett omättat derivat av skvalan – skvalen, en förening som är viktig för ämnesomsättningen, upptäcktes först i levern på en haj). Trivialnamnet för pentylradikalen (C 5 H 11) är amyl. Det kommer från grekiskan. amylon– stärkelse: en gång i tiden kallades isoamylalkohol C 5 H 11 OH (3-metylbutanol-1) "jäsningsamylalkohol", eftersom den utgör grunden för fuselolja och den bildas som ett resultat av jäsningen av sockerhaltiga ämnen - produkter av stärkelsehydrolys.
Den enklaste medlemmen av cykloalkanserien C n H 2 n– cyklopropan ( n= 3). Dess homologer kallas samma som alkaner med tillägg av prefixet "cyklo" (cyklobutan, cyklopentan, etc.). I cykloalkaner är isomerism möjlig på grund av närvaron av sidoalkylgrupper och deras placering i ringen. Till exempel är cyklohexan, metylcyklopentan, 1,1-, 1,2- och 1,3-dimetylcyklobutaner, 1,1,2- och 1,2,3-trimetylcyklopropaner isomera.
Antalet alkanisomerer ökar kraftigt med ökande antal kolatomer. Namnen på några alkaner, liksom det teoretiska antalet möjliga isomerer, anges i tabellen.
| Formel | namn | Antal isomerer | Formel | namn | Antal isomerer |
| CH 4 | Metan | 1 | C11N 24 | Undekan | 159 |
| C2H6 | Etan | 1 | C12N 26 | Dodecan | 355 |
| C3H8 | Propan | 1 | C13N 28 | Tridecan | 802 |
| C4H10 | Butan | 2 | C14N30 | Tetradekan | 1858 |
| C5H12 | Pentan | 3 | C15N 32 | Pentadekan | 4347 |
| C6H 14 | Hexan | 5 | C20N 42 | Eikosan | 366319 |
| C7H 16 | Heptan | 9 | C25N52 | Pentacosan | 36797588 |
| C8H 18 | Oktan | 18 | C30N 62 | Triacontan | 4111846763 |
| C9H20 | Nonan | 35 | C40N82 | Tetrakontan | 62481801147341 |
| C10H 22 | Dekanus | 75 | C 100 N 202 | Hektan | cirka 5,921 10 39 |
Att förstå de flesta nomenklaturnamnen på mättade kolväten är inte särskilt svårt även för dem som inte studerade grekiska i ett klassiskt gymnasium. Dessa namn kommer från grekiska siffror med tillägg av suffixet -an. Det är svårare med de första medlemmarna i serien: de använder inte siffror, utan andra grekiska rötter förknippade med namnen på motsvarande alkoholer eller syror. Dessa alkoholer och syror var kända långt innan upptäckten av motsvarande alkaner; ett exempel är etylalkohol och etan (erhölls först 1848).
Metan (liksom metanol, metyl, metylen etc.) har en gemensam rot "met", vilket i kemin betecknar en grupp som innehåller en kolatom: metyl CH 3, metylen (metyliden) CH 2, metin (metylidin) CH. Historiskt sett var den första sådana substansen metyl (även känd som trä) alkohol, metanol, som tidigare erhölls genom torrdestillation av trä. Dess namn kommer från de grekiska orden mety - att berusa vin och hile - skog (så att säga "trävin"). Det mest fantastiska här är att metan, ametist och honung har en gemensam rot! I forntida tider var ädelstenar utrustade med magiska egenskaper (och många tror fortfarande på detta). Således trodde man att vackra lila stenar skyddade mot berusning, särskilt om en drickskopp var gjord av denna sten. Tillsammans med det negativa prefixet visade det sig ametystos - motverka berusning. Ordet honung, visar det sig, finns på nästan alla europeiska språk: engelska. mjöd - honung (som dryck), tyska Met (på forntyska metu), holländska mede, svenska mjöd, danska mjød, litauiska och lettiska medus, för att inte tala om de slaviska språken. Alla dessa ord, inklusive det grekiska, kommer från det indoeuropeiska medhu, som betyder söt dryck. Det grekiska brännvinet Metaxa ligger inte långt efter dem, även om det inte alls är sött.
Etan (liksom eter, etanol, alkohol, alkan) har ett gemensamt ursprung. Forntida grekiska filosofer använde ordet aither för att beskriva en viss substans som genomsyrar kosmos. När alkemister på 800-talet. Man fick en lätt avdunstande vätska från vinalkohol och svavelsyra, det kallades svaveleter. På 1800-talet fick reda på att svavelsyraeter (på engelska ether) tillhör de så kallade etrarna och innehåller en grupp av två kolatomer - samma som etylalkohol (etanol); denna grupp kallades etyl. Namnet på ämnet "etyleter" (C 2 H 5 –O-C 2 H 5) är alltså i huvudsak "oljeolja".
Namnet etan kommer från "etyl". Ett av namnen på etanol, alkohol, är av samma ursprung som ordet alkan (även alken, alkyn, alkyl). På arabiska betyder al-kohl pulver, pulver, damm. Vid minsta andetag stiger de upp i luften, precis som vinångor - "vinets alkohol", som med tiden helt enkelt förvandlades till alkohol.
Varför finns det ett "t" i "etan" och "etanol" och "f" i "eter"? Trots allt, på engelska, till skillnad från ryska, har orden "eter" och "etyl" liknande stavningar och ljud. Kombinationen th går tillbaka till den grekiska bokstaven q (theta); på det ryska språket fram till 1918 hade bokstaven "fita" samma stil, som dock uttalades som "f" och användes endast för att särskilja ord där denna bokstav kommer från grekiskan q och 247 (" phi”). På västeuropeiska språk, grekiska. j gick till ph och q till th. På det ryska språket innehåller många ord "fita" redan på 1700-talet. ersattes med bokstaven ”f”: teater istället för ”qeaftr”, matematik istället för ”maqematics”, teori istället för ”qeory”... I detta avseende är det intressant att det i Dahls ordbok, utgiven 1882, står skrivet eqir, och i Brockhaus och Efrons encyklopediska ordbok (1904) – "eter".
Förresten, estrar i västerländska språk är ester, inte eter. Men ordet "ester" finns inte på det ryska språket, så alla kemister skadas av den analfabetiska översättningen av den engelska polyestern på textilprodukternas etiketter som "polyester" istället för "polyester", "polyesterfiber" (polyestrar) inkluderar till exempel lavsan, terylen, dacron).
Namnen "propan" och "butan" kommer från namnen på motsvarande syror - propionsyra och butansyra (smörsyra). Propionsyra är den "första" (dvs den kortaste kedjan) som finns i fetter ( centimeter. FETTER OCH OLJOR), och dess namn kommer från grekiskan. protos- först och pion– fett. Butan och butansyra smörsyra syra) – från grekiska. butyron- olja; På ryska är butyrater salter och estrar av smörsyra. Denna syra frigörs när oljan härsknar.
Vidare, med början med pentan, är namnen härledda från grekiska siffror. Ett sällsynt undantag är cetan, ett av namnen på C16-hexadekan. Detta ord kommer från namnet cetylalkohol, som erhölls 1823 av den franske kemisten Michel Eugene Chevreul. Chevreul isolerade detta ämne från spermaceti, ett vaxartat ämne från kaskelotens huvud. Ordet spermaceti kommer från grekiskans sperma - frö och ketos - stort havsdjur (val, delfin). Från den latinska stavningen av det andra ordet (cetus) kommer cetylalkohol C 16 H 33 OH (hexadekanol) och cetan.
I det ryska språket finns det många ord med samma rötter som alkaner: Pentagon, heptachord (ljudskala med 7 steg), dodekafoni (metod för musikalisk komposition), oktav, decima och undecima (musikaliska intervall), oktett och nonet (ensembler av 8 och 9 musiker), pentode, hexod och heptode (radiorör); hexameter (poetisk meter), oktaeder, decennium, dekan, hektar, oktober, december, etc. och så vidare.
Alkanen med de längsta molekylerna syntetiserades av engelska kemister 1985. Detta är nonacontatrictan C 390 H 782, som innehåller en kedja av 390 kolatomer. Forskarna var intresserade av hur så långa kedjor skulle packas under kristallisation (flexibla kolvätekedjor kan lätt vikas).
Antal isomerer av alkaner.
Problemet med det teoretiskt möjliga antalet isomerer av alkaner löstes först av den engelske matematikern Arthur Cayley (1821–1895), en av grundarna av en viktig gren av matematiken - topologi (1879 publicerade han den första artikeln om den berömda " problemet med fyra färger”: finns det tillräckligt många för att färga alla geografiska kort; detta problem löstes först 1976). Det visade sig att det inte finns någon formel med vilken man kan använda antalet kolatomer i en C-alkan n H 2 n+2 beräkna antalet av dess isomerer. Det finns bara så kallade återkommande formler (från latin återfall– återvändande), som låter dig beräkna antalet isomerer n:e medlemmen i serien, om antalet isomerer av den föregående medlemmen redan är känt. Därför beräkningar för stora n erhölls relativt nyligen med användning av datorer och reducerades till kolväte C 400 H 802; för den, med hänsyn till rumsliga isomerer, erhölls ett värde som är svårt att föreställa sig: 4,776·10 199. Och med start från alkanen C 167 H 336 överstiger antalet isomerer antalet elementarpartiklar i den synliga delen av universum, vilket uppskattas till 10 80. Antalet isomerer som anges i tabellen för de flesta alkaner kommer att öka avsevärt om vi även tar hänsyn till spegelsymmetriska molekyler - stereoisomerer ( centimeter. OPTISK ISOMERISM): för heptan - från 9 till 11, för dekan - från 75 till 136, för eikosan - från 366 319 till 3 396 844, för hektan - från 5,921 10 39 till 1,373 10 46, etc.
Ur en kemists synvinkel är antalet strukturella isomerer av mättade kolväten av praktiskt intresse endast för de första medlemmarna i serien. Även för en relativt enkel alkan som bara innehåller ett och ett halvt dussin kolatomer har det överväldigande antalet isomerer inte erhållits och kommer sannolikt inte att syntetiseras någonsin. Till exempel syntetiserades den sista av de teoretiskt möjliga 75 isomererna av dekan först 1968. Och detta gjordes i praktiska syften - för att få en mer komplett uppsättning standardföreningar genom vilka olika kolväten, till exempel de som finns i olja, kan identifieras. Förresten, alla 18 möjliga oktanisomerer har hittats i olika typer av olja.
Men det mest intressanta är att, med början med heptadekan C 17 H 36, först bara några av det teoretiskt möjliga antalet isomerer, sedan många, och slutligen nästan alla, är ett slående exempel på "papperskemi", dvs. kan inte existera i verkligheten. Faktum är att när antalet kolatomer i molekylerna av grenade isomerer ökar, uppstår allvarliga problem med rumslig packning. Trots allt behandlade matematiker kol- och väteatomer som punkter, när de i själva verket har en ändlig radie. Således har en metan "boll" 4 väteatomer på sin "yta", som är fritt placerade på den. I neopentan C(CH 3) 4 finns det redan 12 väteatomer på "ytan", belägna mycket närmare varandra; men det finns fortfarande plats för dem att placeras. Men för alkan 4 (C 17 H 36) finns det inte tillräckligt med utrymme på ytan för att rymma alla 36 väteatomer i 12 metylgrupper; Detta är lätt att kontrollera om du ritar en platt bild (eller, ännu bättre, gör en tredimensionell modell av plasticine och tändstickor) för liknande isomerer, och bibehåller konstantiteten för C–C- och C–H-bindningslängderna och alla vinklar mellan dem). Med tillväxt n placeringsproblem uppstår även för kolatomer. Som ett resultat, trots att antalet möjliga isomerer ökar nökar mycket snabbt, andelen "pappers" isomerer växer mycket snabbare. En datorbaserad bedömning visade att som n förhållandet mellan antalet verkligt möjliga isomerer och antalet "pappers" närmar sig snabbt noll. Det är därför beräkningen av det exakta antalet isomerer av mättade kolväten för stora n, som en gång väckte stort intresse, har nu endast teoretisk betydelse för kemister.
Struktur och fysikaliska egenskaper hos alkaner.
Alkaner har fyra sp 3 hybridorbitaler av kolatomen ( centimeter. ORBITALER) är riktade mot tetraederns hörn med en vinkel mellan dem på cirka 109°28" - det är i detta fall som repulsionen mellan elektroner och systemets energi är minimal. Som ett resultat av överlappningen av dessa orbitaler med varandra, såväl som med s-orbitaler av väteatomer bildar s-bindningar C–C och C–H. Dessa bindningar i alkanmolekyler är kovalenta icke-polära eller lågpolära.
Alkaner är uppdelade i primära kolatomer (de är bundna till endast en angränsande C-atom), sekundära (bundna till två C-atomer), tertiära (bundna till tre C-atomer) och kvartära (bundna till fyra C-atomer). I 2,2-dimetyl-3-metylpentan CH 3 –C(CH 3) 2 –CH(CH 3) – CH 2 –CH 3 finns det alltså en kvartär, en tertiär, en sekundär och fem primära kolatomer. De olika miljöerna för kolatomer påverkar i hög grad reaktiviteten hos de väteatomer som är associerade med dem.
Det rumsliga arrangemanget av sp 3 orbitaler leder, med början från propan, till en sicksack-konfiguration av kolkedjor. I det här fallet är rotation av molekylära fragment runt C–C-bindningar möjlig (i en etanmolekyl vid 20 ° C - med en hastighet av miljoner varv per sekund!), vilket gör molekylerna i högre alkaner flexibla. Uträtning av sådana kedjor sker till exempel vid sträckning av polyeten, som består av en blandning av alkaner med långa kedjor.Alkanmolekyler samverkar svagt med varandra, därför smälter och kokar alkaner vid mycket lägre temperaturer än liknande ämnen med polära molekyler. De första fyra medlemmarna av den homologa serien av metan är gaser under normala förhållanden; propan och butan kan lätt göras till flytande under lågt tryck (en flytande propan-butanblandning finns i hushållsgasflaskor). Högre homologer är vätskor med lukten av bensin eller fasta ämnen som är olösliga i vatten och flyter på dess yta. Smält- och kokpunkterna för alkaner ökar med ökande antal kolatomer i molekylen, medan temperaturökningen gradvis saktar ner, till exempel smälter C 100 H 202 vid 115 ° C, C 150 H 302 - vid 123 ° C. Smältning och kokpunkter för de första 25 alkanerna anges i tabellen - det är tydligt att från oktadekan är alkaner fasta ämnen.
| Tabell. ALKANERS SJÄLT- OCH KOKTEMPERATURER | ||
| Alkan | T pl | T bal |
| Metan | –182,5 | –161,5 |
| Etan | –183,3 | –88,6 |
| Propan | –187,7 | –42,1 |
| Butan | –138,4 | –0,5 |
| Pentan | –129,7 | 36,1 |
| Hexan | –95,3 | 68,7 |
| Heptan | –90,6 | 98,4 |
| Oktan | –56,8 | 125,7 |
| Nonan | –51,0 | 150,8 |
| Dekanus | –29,7 | 174,1 |
| Undekan | –25,6 | 195,9 |
| Dodecan | –9,6 | 216,3 |
| Tridecan | –5,5 | 235,4 |
| Tetradekan | +5,9 | 253,7 |
| Pentadekan | +9,9 | 270,6 |
| Hexadekan | 18,2 | 286,8 |
| Heptadekan | 22,0 | 301,9 |
| Octadecan | 28,2 | 316,1 |
| Nonadecane | 32,1 | 329,7 |
| Eikosan | 36,8 | 342,7 |
| Geneikozan | 40,5 | 356,5 |
| Docozan | 44,4 | 368,6 |
| Tricozan | 47,6 | 378,3 |
| Tetrakosan | 50,9 | 389,2 |
| Pentacosan | 53,7 | 399,7 |
Närvaron av en gren i kedjan förändrar dramatiskt de fysikaliska egenskaperna, särskilt smältpunkten. Så, om hexan har en normal struktur ( n-hexan) smälter vid –95,3°C, sedan smälter dess isomera 2-metylpentan vid –153,7°C. Detta beror på svårigheten att packa grenade molekyler under deras kristallisation. Som ett resultat kristalliseras inte alkaner med kedjegrenar vid snabb kylning, utan omvandlas till det glasartade tillståndet av en underkyld vätska ( centimeter. GLAS). Till exempel, om en tunn ampull med pentan nedsänks i flytande kväve (temperatur -196 ° C), kommer ämnet att förvandlas till en vit snöliknande massa, medan isopentan (2-metylbutan) stelnar till ett genomskinligt "glas".
En originell metod för att separera dem är baserad på skillnaden i geometrisk form av linjära och grenade alkaner: ureakristaller har kanaler där rakkedjiga alkaner kan passa, men grenade inte.
Cykloalkaner med n= 2, 3 – gaser, högre – vätskor eller fasta ämnen. Den största cykeln som kemister har kunnat syntetisera är cyklooktaoktakontadiktan C 288 H 576. De olika formerna på cykloalkanmolekyler med jämna och udda antal kolatomer i molekylen leder till en stark jämn-udda effekt vad gäller smältpunkten, vilket framgår av tabellen. Denna effekt förklaras av skillnaden i "bekvämligheten" med att packa molekyler av olika former i en kristall: ju mer kompakt packningen är, desto starkare är kristallen och desto högre smältpunkt. Till exempel smälter cyklododekan nästan 70° högre än sin närmaste homolog, cykloundekan. Naturligtvis spelar molekylens massa också roll: lätta molekyler smälter vid lägre temperatur.
| C3H6 | –127,5 |
| C4H8 | –50 |
| C5H10 | –93,9 |
| C6H 12 | +6,5 |
| C7H 14 | –12 |
| C8H 16 | 14,3 |
| S 9 H 18 | 9,7 |
| C10N20 | 10,8 |
| C11N 22 | –7,2 |
| C12H24 | 61,6 |
| C13N 26 | 23,5 |
| C14N 28 | 54 |
| C15N30 | 62,1 |
Lättheten att rotera runt C–C-bindningen leder till att cykloalkanernas molekyler inte är plana (med undantag för cyklopropan), på så sätt undviker de stark förvrängning av bindningsvinklar. Således, i cyklohexan och dess högre homologer är bindningsvinklarna avslappnade och nära tetraedriska (109°), medan vinklarna i en hexagon är 120°, i en oktagon - 135°, etc. Individuella kolatomer i sådana cykloalkaner upptar inte en styvt fixerad position: ringen verkar vara i konstant vågliknande rörelse. En cyklohexanmolekyl kan alltså vara i form av olika geometriska strukturer (konformers) som kan omvandlas till varandra (cykelinversion). På grund av deras yttre likhet kallades de "badkar" och "stol" (i engelsk litteratur kallas ett "badkar" en "båt"):
Formen på stolen är mer stabil; Vid vanliga temperaturer finns 99,9 % cyklohexan i den mer stabila stolformen. Övergången mellan två former sker genom en mellanliggande "vridkonformation" (från engelska. vrida– vridning).
I cyklopropan minskar vinkeln från 108° till 60°, vilket resulterar i högspänning och "böjda" bindningar som ligger mellan normala s- och p-bindningar; På grund av sin form kallas dessa bindningar "bananbindningar". I detta fall överlappar kolatomernas sp 3 orbitaler endast delvis. Resultatet är dualitet i de kemiska egenskaperna hos cyklopropan. Å ena sidan är substitution av väteatomer möjlig i den (en reaktion typisk för alkaner), å andra sidan är addition med ringöppning möjlig (reaktion typisk för alkener, till exempel: cyklo-C3H6 + Br2® BrCH2CH2CH2Br).
Cykloalkaner med två ringar och en gemensam kolatom kallas spiroalkaner. Om det finns fler än två vanliga kolatomer bildas bicykloalkaner, tricykloalkaner etc. Som ett resultat av sådan "tvärbindning" av flera cykler samtidigt lyckades kemister erhålla kolväten, vars rumsliga struktur motsvarar olika polyedrar: tetraeder, kub, prisma, etc. Bicykliska derivat cyklohexan finns i eteriska oljor, barrharts och terpentin. En cykel med sex och fem kolatomer finns i kamfer, kolesterol, sackarin, piperin (det ger den heta smaken till svartpeppar), kvävebaser - nukleotider och andra föreningar (vissa kolatomer i cyklerna kan kopplas samman med dubbelbindningar och några är substituerade andra atomer, såsom i sackarin). En cykel med 17 kolatomer (två av dem förbundna med en dubbelbindning) finns i civeton, ett luktämne, en komponent av mysk, som används i parfymer. Den vackra adamantanmolekylen innehåller tre sexledade ringar och dess struktur motsvarar diamantens kristallgitter. Adamantanstrukturen finns i det antivirala läkemedlet rimantadine, i hexametylentetramin (i den senare föreningen är 4 kolatomer ersatta av kväveatomer, som är förbundna med varandra genom metylenbryggor – CH 2 –). Nedan visas strukturerna för några cykloalkaner, vars molekyler har mer än en på olika sätt sammankopplad ring.
Bicyklodekan (tetrahydronaftalen, dekalin)
Adamantane
Kemiska egenskaper hos alkaner.
Alkaner är de minst kemiskt aktiva organiska föreningarna. Alla C–C- och C–H-bindningar i alkaner är enkla, så alkaner är oförmögna till additionsreaktioner. Alkaner kännetecknas av reaktioner av ersättning av väteatomer med andra atomer och grupper av atomer. Sålunda, när metan kloreras, bildas metylklorid CH3Cl, metylenklorid CH2Cl2, triklormetan (kloroform) CHCl3 och koltetraklorid (koltetraklorid) CC14. Dessa reaktioner följer en kedjemekanism med mellanliggande bildning av fria radikaler.
Vid klorering av alkaner, med början på propan, kan den allra första kloratomen ersätta olika väteatomer. Substitutionens riktning beror på styrkan hos C–H-bindningen: ju svagare den är, desto snabbare substitution av just denna atom. Primära C–H-bindningar är vanligtvis starkare än sekundära, och sekundära är starkare än tertiära. Som ett resultat sker klorering vid 25°C längs den sekundära bindningen (CH 3) 2 CH–H 4,5 gånger snabbare än genom den primära bindningen C 2 H 5 –H, och den tertiära bindningen (CH 3) 3 C–H – 6,7 gånger snabbare. Den olika reaktiviteten hos primära, sekundära och tertiära väteatomer kan resultera i att endast en av flera möjliga kloreringsprodukter är dominerande. Till exempel, när 2,3-dimetylbutan kloreras i en lösning av koldisulfid (CS 2), bildas 95 % av 2-klorderivatet och endast 5 % av 1-klorderivatet, d.v.s. 19 gånger mindre. Om vi tar hänsyn till att det i den ursprungliga alkanen finns 6 gånger fler primära väteatomer än tertiära, så kommer förhållandet mellan deras reaktivitet att vara ännu större (19 ґ 6 = 114). Koldisulfid som lösningsmedel minskar kloratomernas reaktivitet och ökar följaktligen dess selektivitet. Att sänka temperaturen fungerar på samma sätt.
Bromatomer är mindre aktiva; Den märkbara aktiveringsenergin för denna reaktion leder till det faktum att bromering av alkaner, även om den sker genom en kedjemekanism, är mycket långsammare än klorering, och endast vid förhöjda temperaturer eller i ljus. Den lägre aktiviteten hos bromatomer leder också till ökad selektivitet av bromering. Således, om den relativa hastigheten för fotokemisk bromering av etan vid 40°C tas lika med 1, kommer bromeringshastigheten för propan (vid den sekundära H-atomen) redan att vara 220 under samma förhållanden, och bromeringshastigheten av isobutan (vid den tertiära H-atomen) kommer att vara 19 000
Jodatomer är de minst aktiva, därför är reaktionen av jodering av alkanerna RH + I 2 ® RI + HI endotermisk, möjlig endast vid höga temperaturer och sker med mycket korta kedjor. Dessutom uppträder den omvända exoterma reaktionen RI + HI® RH + I2 mycket lätt. När alkaner joderas bildas även omättade föreningar. Till exempel, vid 685°C bildar etan, som reagerar med jod, 72% eten och 10% acetylen. Samma resultat erhölls med propan, butan och pentan.
Fluoreringsreaktionen av alkaner fortskrider med en mycket hög, ofta explosiv, hastighet med bildning av alla möjliga polyfluorerade derivat av den ursprungliga alkanen. Energin som frigörs vid fluoreringen av alkaner är så stor att den kan leda till nedbrytning av produktmolekyler till radikaler som startar nya kedjor. Som ett resultat ökar reaktionshastigheten som en lavin och detta leder till en explosion även vid låga temperaturer. Det speciella med fluoreringen av alkaner är möjligheten att förstöra kolskelettet av fluoratomer med bildandet av CF4 som slutprodukt med andra halogener, en sådan reaktion inträffar inte.
Nitrering av alkaner (Konovalovs reaktion) följer också en radikal mekanism: RH + NO 2 ® R· + HNO 2, R· + NO 2 ® RNO 2. Källan till NO 2 är salpetersyra, som sönderdelas vid upphettning. Reaktionen utförs i lösning vid temperaturer över 150°C eller i ånga under tryck upp till 10 atm och en temperatur på 400 – 500°C. I det senare fallet bryts även C–C-bindningar i alkaner och en blandning av nitroalkaner bildas.
Alla alkaner brinner genom att avge värme, till exempel: C 5 H 12 + 8O 2 ® 5CO 2 + 6H 2 O. Denna reaktion sker i synnerhet i cylindrarna i förbränningsmotorer. För att förhindra att rester av oförbrända alkaner kommer in i atmosfären används deras katalytiska efterförbränning i avgasrör (samtidigt förbränns CO och kväveoxider omvandlas till ofarligt kväve). Reaktionen av syre med högre alkaner (i paraffin) uppstår när ett ljus brinner. Gasformiga alkaner, såsom metan, bildar explosiva blandningar med luft. Sådana blandningar kan bildas i gruvor, såväl som i bostadshus på grund av ett läckage av hushållsgas om dess innehåll i luften når 5%.
Betydande ansträngningar från kemister var inriktade på en detaljerad studie av reaktionen av lågtemperaturoxidation av alkaner för att stoppa den vid bildningsstadiet av värdefulla mellanprodukter - aldehyder, ketoner, alkoholer, karboxylsyror. Sålunda, i närvaro av Co(II)- och Mn(II)-salter kan butan oxideras till ättiksyra och paraffin till C12–C18-fettsyror. Oxidationen av cyklohexan producerar kaprolaktam, en monomer för produktion av kapron, och adipinsyra.
En viktig industriell reaktion är den fotokemiska sulfokloreringen av alkaner: en gemensam radikalkedjereaktion med Cl 2 och SO 2 med bildning av alkansulfonsyraklorider RSO 2 Cl. Denna reaktion används i stor utsträckning vid tillverkning av tvättmedel. När klor ersätts med syre uppstår en radikalkedjereaktion av sulfonoxidation av alkaner med bildning av alkansulfonsyror R–SO 2 –OH. Natriumsalter av dessa syror används som rengöringsmedel och emulgeringsmedel.
Vid höga temperaturer sker nedbrytning (pyrolys) av alkaner, till exempel: CH 4 ® C + 2H 2 (1000° C), 2CH 4 ® C 2 H 2 + 3H 2 (1500° C), C 2 H 6 ® C 2H4+H2. Den sista reaktionen sker vid 500°C i närvaro av en katalysator (Ni). På liknande sätt kan 2-buten CH3CH = CHCH3 erhållas från butan, samtidigt bildas en blandning av eten och etan. I motsats till denna radikala reaktion sker katalytisk krackning av alkaner genom en jonmekanism och tjänar till att producera bensin från tyngre petroleumfraktioner. Vid upphettning i närvaro av Lewis-syror, till exempel AlCl 3, sker isomerisering: ogrenade (normala) alkaner omvandlas till grenade med samma antal kolatomer. Denna reaktion är av stor praktisk betydelse för att erhålla högkvalitativt motorbränsle ( centimeter. OKTANTAL). Dehydrering av alkaner kan åtföljas av ringslutning (dehydrocyklisering). I fallet med hexandehydrocyklisering är huvudprodukten bensen.
Metan vid hög temperatur i närvaro av en katalysator reagerar med vattenånga och kolmonoxid (IV) för att bilda syntesgas: CH 4 + H 2 O ® CO + 3H 2, CH 4 + CO 2 ® 2CO + 2H 2. Syntesgas används för att producera motorbränslen och metylalkohol.
Under de senaste åren har kemisters ansträngningar varit inriktade på att skapa katalysatorer som aktiverar CH-bindningar i alkanmolekyler under milda förhållanden. Vissa mikroorganismer "kan" utföra sådana reaktioner, vars enzymer kan "smälta" till och med paraffin med bildandet av proteinföreningar. Kemisters uppgift är att förstå hur naturliga katalysatorer fungerar och att modellera enzymatiska reaktioner som kan inträffa vid vanliga temperaturer. I detta fall används olika organometalliska föreningar som katalysatorer. Till exempel, i närvaro av vissa platinaföreningar, kan metanol CH3OH erhållas direkt från metan, och i närvaro av ett trifenylfosfinkomplex av rodium Rh[(C6H5)3P] associerat med CO-molekyler; Under reaktionen införs CO-molekyler i C–H-bindningarna av alkaner för att bilda aldehyder.
Cykloalkaner har kemiska egenskaper som liknar alkaner. Således är de brandfarliga, kan halogeneras genom en radikal mekanism, och vid förhöjda temperaturer i närvaro av katalysatorer dehydreras de - de spjälkar av väte och förvandlas till omättade kolväten. Som nämnts har cyklopropan speciella egenskaper. Till skillnad från alkaner hydreras cykloalkaner, när ringen öppnas och alkaner bildas, till exempel: cyklo-C3H6 + H2® C3H8 (reaktionen sker vid upphettning i närvaro av en platinakatalysator). När storleken på cykeln ökar blir reaktionen svårare - alltså är cyklopentan redan hydrerad (till pentan) med stor svårighet och vid höga temperaturer (300 ° C).
Att vara i naturen och ta emot.
De huvudsakliga källorna till alkaner är olja och naturgas. Metan utgör huvuddelen av naturgas, den innehåller även små mängder etan, propan och butan. Metan finns i utsläpp från träsk och kollag. Tillsammans med lätta homologer finns metan i associerade petroleumgaser. Dessa gaser löses i olja under tryck och är också belägna ovanför den. Alkaner utgör en betydande del av petroleumprodukter. Olja innehåller också cykloalkaner - de kallas naftener (från grekiskan. nafta- olja). Gashydrater av alkaner, främst metan, är också utbredda i naturen, de förekommer i sedimentära bergarter på kontinenter och på botten av haven. Deras reserver överstiger förmodligen de kända naturgasreserverna och kan i framtiden bli en källa till metan och dess närmaste homologer.
Alkaner erhålls också genom pyrolys (koksning) av kol och dess hydrogenering (produktion av syntetiskt flytande bränsle). Fasta alkaner finns i naturen i form av avlagringar av bergsvax - ozokerit, i vaxartade beläggningar av löv, blommor och växtfrön, och är en del av bivax.
Inom industrin produceras alkaner genom katalytisk hydrogenering av koloxiderna CO och CO 2 (Fischer-Tropsch-metoden). I laboratoriet kan metan erhållas genom att värma natriumacetat med en fast alkali: CH 3 COONa + NaOH ® CH 4 + Na 2 CO 3, samt genom hydrolys av vissa karbider: Al 4 C 3 + 12H 2 O ® 3CH 4 + 4Al(OH)3. Homologer av metan kan erhållas genom Wurtz-reaktionen, till exempel: 2CH 3 Br + 2Na ® CH 3 – CH 3 + 2NaBr. När det gäller dihaloalkaner erhålls cykloalkaner, till exempel: Br–CH 2 –(CH 2) 4 –CH 2 Br + 2Na ® cyklo-C6H12 + 2NaBr. Alkaner bildas också under dekarboxylering av karboxylsyror och under deras elektrolys.
Applicering av alkaner.
Alkaner i bensin, fotogen, dieselolja och eldningsolja används som bränsle. Högre alkaner finns i smörjoljor, vaselin och paraffin. En blandning av isomera pentaner och hexaner kallas petroleumeter och används som lösningsmedel. Cyklohexan används också i stor utsträckning som lösningsmedel och för syntes av polymerer (nylon, nylon). Cyklopropan används för anestesi. Squalane är en högkvalitativ smörjolja, en komponent i farmaceutiska och kosmetiska preparat och en adsorbent i gas-vätskekromatografi.
Alkaner fungerar som råmaterial för produktion av många organiska föreningar, inklusive alkoholer, aldehyder och syror. Klorderivat av alkaner används som lösningsmedel, till exempel triklormetan (kloroform) CHCl 3, koltetraklorid CCl 4. En blandning av högre alkaner - paraffin är giftfri och används i stor utsträckning inom livsmedelsindustrin för impregnering av behållare och förpackningsmaterial (till exempel mjölkkartonger) och vid tillverkning av tuggummi. Pennor och den övre delen (nära huvudet) av tändstickor är impregnerade med paraffin för bättre bränning. Uppvärmt paraffin används för medicinska ändamål (paraffinbehandling). Oxidation av paraffin under kontrollerade förhållanden i närvaro av katalysatorer (organiska övergångsmetallsalter) leder till produktion av syrehaltiga produkter, främst organiska syror.
Ilya Leenson
Litteratur:
Petrov A.A. Alkanernas kemi. M., Nauka, 1974
Azerbaev I.N. och så vidare. Synteser baserade på petroleumkolväten. Alma-Ata, Vetenskap, 1974
Rudakov E.S. Reaktioner av alkaner med oxidationsmedel, metallkomplex och radikaler i lösningar. Kiev, Naukova Dumka, 1985
Parauşanu V. Produktion och användning av kolväten. M., Chemistry, 1987