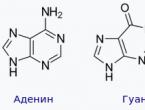
Alcani pe scurt. Alcani: proprietăți chimice
Proprietățile fizice ale alcanilor
În condiții normale, primii patru membri ai seriei omoloage de alcani (C 1 - C 4) sunt gaze. Alcanii normali de la pentan la heptadecan (C 5 - C 17) sunt lichizi, începând de la C 18 și mai sus sunt solide. Pe măsură ce numărul de atomi de carbon din lanț crește, de ex. Pe măsură ce greutatea moleculară relativă crește, punctele de fierbere și de topire ale alcanilor cresc.
Cu același număr de atomi de carbon în moleculă, alcanii ramificati au puncte de fierbere mai mici decât alcanii normali.
Alcanii sunt practic insolubili în apă, deoarece moleculele lor sunt cu polaritate scăzută și nu interacționează cu moleculele de apă. Alcanii lichizi se amestecă ușor între ei. Se dizolvă bine în solvenți organici nepolari, cum ar fi benzenul, tetraclorura de carbon etc.
Structura
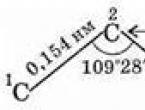
Molecula celui mai simplu alcan - metanul - are forma unui tetraedru regulat, în centrul căruia se află un atom de carbon, iar la vârfuri se află atomi de hidrogen. Unghiurile dintre axele legăturilor C-H sunt de 109°28" (Fig. 29).
În moleculele altor hidrocarburi saturate, unghiurile dintre legături (atât C-H, cât și C-C) au aceeași semnificație. Pentru a descrie forma moleculelor se folosește conceptul de hibridizare a orbitalilor atomici(vezi Partea I, §6).
În alcani, toți atomii de carbon sunt în stare sp 3 - hibridizare (Fig. 30).
Astfel, atomii de carbon din lanțul de carbon nu sunt în linie dreaptă. Distanța dintre atomii de carbon vecini (între nucleele atomilor) este strict fixată - aceasta este lungimea legăturii chimice(0,154 nm). Distanța C 1 - C 3, C 2 - C 4 etc. (prin un atom) sunt de asemenea constante, deoarece unghiul dintre legături este constant - unghi de legătură.

Distanțele dintre atomii de carbon mai îndepărtați se pot modifica (în anumite limite) ca urmare a rotației în jurul legăturilor S. Această rotație nu perturbă suprapunerea orbitalilor care formează legătura s, deoarece această legătură are simetrie axială.


Diferite forme spațiale ale unei molecule formate prin rotația grupurilor de atomi în jurul legăturilor S se numesc conformaţiilor(Fig. 31).
Conformațiile diferă ca energie, dar această diferență este mică (12-15 kJ/mol). Conformatiilor alcanilor in care atomii sunt situati cat mai indepartati unul de altul sunt mai stabile (repulsie a invelisurilor de electroni). Trecerea de la o conformație la alta se realizează datorită energiei mișcării termice. Pentru a descrie conformația, sunt folosite formule spațiale speciale (formulele lui Newman).
Nu fi confuz!
Este necesar să se facă distincția între conceptele conformație și configurație.
Diferitele conformații se pot transforma unele în altele fără a rupe legăturile chimice. Pentru a transforma o moleculă cu o configurație într-o moleculă cu altă configurație necesită ruperea legăturilor chimice.
De patru tipuri izomerie Alcanii sunt caracterizați prin două: izomeria scheletului de carbon și izomeria optică (vezi partea
Legăturile chimice în alcani, ruperea și formarea lor determină proprietățile chimice ale alcanilor. Legăturile C-C și C-H sunt covalente, simple (legături s), practic nepolare, destul de puternice, prin urmare:
1) alcanii intră cel mai adesea în reacții care implică scindarea hemolitică a legăturilor;
2) în comparație cu compușii organici din alte clase, alcanii au reactivitate scăzută (pentru aceasta se numesc parafine- „lipsit de proprietăți”). Astfel, alcanii sunt rezistenți la acțiunea soluțiilor apoase de acizi, alcaline și agenți de oxidare (de exemplu, permanganat de potasiu) chiar și atunci când sunt fierți.
Alcanii nu reacţionează cu adăugarea altor molecule la ei, deoarece Alcanii nu au legături multiple în moleculele lor.
Alcanii se descompun sub încălzire puternică în prezența catalizatorilor sub formă de platină sau nichel, iar hidrogenul este eliminat din alcani.
Alcanii pot suferi reacții de izomerizare. Reacția lor tipică este reacție de substituție, procedând printr-un mecanism radical.
Proprietăți chimice
Reacții de deplasare radicală
Ca exemplu, luați în considerare interacțiunea alcanilor cu halogenii. Fluorul reacționează foarte energic (de obicei cu o explozie) - în acest caz, toate legăturile C-H și C-C sunt rupte și, ca urmare, se formează compuși CF 4 și HF. Reacția nu are nicio semnificație practică. Iodul nu interacționează cu alcanii. Reacțiile cu clorul sau bromul apar fie cu lumină, fie cu căldură puternică; în acest caz, are loc formarea de alcani substituiți de mono până la polihalogen, de exemplu:
CH3-CH3+Cl2® hv CH3-CH2-Cl+HCI
Formarea derivaților de halogen metan are loc printr-un lanț radical liber mecanism. Sub influența luminii, moleculele de clor se descompun în radicali anorganici:
Radical anorganic Cl. extrage un atom de hidrogen cu un electron dintr-o moleculă de metan, formând HC1 și radicalul liber CH3
![]()
Radicalul liber interacționează cu molecula de clor Cl 2, formând un derivat de halogen și un radical de clor.
![]()
Reacția de oxidare începe cu extracția unui atom de hidrogen de către o moleculă de oxigen (care este un diradical) și apoi continuă ca o reacție în lanț ramificat. Numărul de radicali crește în timpul reacției. Procesul este însoțit
prin eliberarea unei cantități mari de căldură, nu numai legăturile C-H, ci și legăturile C-C sunt rupte, astfel încât, ca urmare, se formează monoxid de carbon (IV) și apă. Reacția poate avea loc ca ardere sau poate duce la o explozie.
2С n Н2 n+2 +(3n+1)О 2 ®2nСО 2 +(2n+2)Н 2 O
La temperaturi obișnuite, reacția de oxidare nu are loc; poate fi iniţiat fie prin aprindere, fie prin descărcare electrică.
Cu o încălzire puternică (peste 1000°C), alcanii se descompun complet în carbon și hidrogen. Această reacție se numește piroliza.
CH4® 1200°C+2H2
Prin oxidarea ușoară a alcanilor, în special a metanului, cu oxigenul atmosferic în prezența diferiților catalizatori, se poate obține alcool metilic, formaldehidă și acid formic.

Dacă metanul este trecut printr-o zonă încălzită foarte repede și apoi imediat răcit cu apă, rezultatul este acetilena.
Această reacție stă la baza unei sinteze industriale numite cracare(descompunere incompletă) a metanului.
Cracarea omologilor de metan se realizează la o temperatură mai scăzută (aproximativ 600°C). De exemplu, cracarea propanului include următoarele etape:

Deci, cracarea alcanilor duce la formarea unui amestec de alcani și alchene cu greutate moleculară mai mică.
Încălzirea alcanilor la 300-350°C (cracarea nu a avut loc încă) în prezența unui catalizator (Pt sau Ni) duce la dehidrogenare- eliminarea hidrogenului.

Când acidul azotic diluat acționează asupra alcanilor la 140°C și presiune joasă, are loc o reacție radicală:
CH3-CH3 + HNO3®CH3-CH2-NO2 + H2O Izomerizarea
În anumite condiții, alcanii normali se pot transforma în alcani cu lanț ramificat.
Prepararea alcanilor
Să luăm în considerare producția de alcani folosind exemplul producției de metan. Metanul este larg răspândit în natură. Este componenta principală a multor gaze inflamabile, atât naturale (90-98%), cât și artificiale, eliberate în timpul distilării uscate a lemnului, turbei, cărbunelui, precum și în timpul cracării petrolului. Gazele naturale, în special gazele asociate din câmpurile petroliere, conțin etan, propan, butan și pentan pe lângă metan.
Metanul este eliberat din fundul mlaștinilor și din straturile de cărbune din mine, unde se formează în timpul descompunerii lente a resturilor vegetale fără acces la aer. Prin urmare, metanul este adesea numit gaz de mlaștină sau grindă.
În laborator, metanul este produs prin încălzirea unui amestec de acetat de sodiu și hidroxid de sodiu:
CH3COONa+NaOH® 200 ° Na2C03+CH4
sau când carbura de aluminiu interacționează cu apa: Al 4 Cl 3 +12H 2 O®4Al(OH) 3 +3CH 4
În acest din urmă caz, metanul se dovedește a fi foarte pur.
Metanul poate fi produs din substanțe simple prin încălzire în prezența unui catalizator:
C+2H2 ® Ni CH 4 8 tot prin sinteză pe bază de apă gazoasă
CO+3H2® Ni CH4 +H2O
Această metodă este de importanță industrială. Cu toate acestea, se utilizează de obicei metanul din gazele naturale sau gazele formate în timpul cocsării cărbunelui și în timpul rafinării petrolului.
Omologuri metanului, ca și metanul, se obțin în condiții de laborator prin calcinarea sărurilor acizilor organici corespunzători cu alcalii. O altă metodă este reacția Wurtz, adică. încălzirea derivaților monohalogen cu sodiu metalic, de exemplu:
C2H5Br+2Na+BrC2H6® C2H5-C2H5+2NaBr
În tehnologie, sinteza este folosită pentru a produce benzină tehnică (un amestec de hidrocarburi care conține 6-10 atomi de carbon).
din monoxid de carbon (II) și hidrogen în prezența unui catalizator (compus de cobalt) și la presiune ridicată. Proces
poate fi exprimat prin ecuație
nСО+(2n+1)Н 2 ® 200° C n H 2n+2 +nН 2 O
I Deci, principalele surse de alcani sunt gazele naturale și petrolul. Cu toate acestea, unele hidrocarburi saturate sunt sintetizate din alți compuși.
Aplicații ale alcanilor
Majoritatea alcanilor sunt folosiți drept combustibil. Crapatura si
Dehidrogenarea lor duce la hidrocarburi nesaturate, care
din care se obţin multe alte substanţe organice.
Metanul este cea mai mare parte a gazelor naturale (60-99%). Parte
gazele naturale includ propanul și butanul. Hidrocarburi lichide
folosit ca combustibil în motoarele cu ardere internă, mașini, avioane etc. Un amestec purificat de lichid
iar alcanii solizi formează vaselina. Alcanii superiori sunt
materii prime pentru producerea detergenţilor sintetici. Alcanii obținuți prin izomerizare sunt utilizați în producția de benzină și cauciuc de înaltă calitate. Mai jos este o diagramă a utilizării metanului

Cicloalcani
Structura
Cicloalcanii sunt hidrocarburi saturate ale căror molecule conțin un inel închis de atomi de carbon.
Cicloalcanii (cicloparafinele) formează o serie omoloagă cu formula generală C n H 2 n, în care primul membru este
ciclopropan C3H6, deoarece Pentru a forma un inel, trebuie să fie prezenți cel puțin trei atomi de carbon.
Cicloalcanii au mai multe denumiri: cicloparafine, naftene, ciclani, polimetilene. Exemple de conexiuni:

Formula CnH2n este caracteristică cicloparafinelor și exact aceeași formulă descrie seria omoloagă de alchene (hidrocarburi nesaturate având o legătură multiplă). Din aceasta putem concluziona că fiecare cicloalcan este izomer cu o alchenă corespunzătoare - acesta este un exemplu de izomerie „interclasă”.
Cicloalcanii sunt împărțiți într-un număr de grupuri în funcție de dimensiunea inelului, dintre care vom lua în considerare două: cicluri mici (C 3, C 4) și obișnuite (C 5 -C 7).
Denumirile cicloalcanilor sunt construite prin adăugarea prefixului ciclo- la numele alcanului cu numărul corespunzător de atomi de carbon. Numerotarea în ciclu este efectuată astfel încât substituenții să primească cele mai mici numere.
Formulele structurale ale cicloalcanilor sunt de obicei scrise în formă prescurtată, folosind forma geometrică a inelului și omițând simbolurile pentru atomii de carbon și hidrogen. De exemplu:

Izomeria structurală a cicloalcanilor este determinată de mărimea inelului (ciclobutanul și metilciclopropanul sunt izomeri) și de poziția substituenților în inel (de exemplu, 1,1- și 1,2-dimetilbutan), precum și de structura lor. .
Izomeria spațială este, de asemenea, caracteristică cicloalcanilor, deoarece este asociat cu diferite aranjamente ale substituenților în raport cu planul inelar. Când substituenții sunt plasați pe o parte a planului inelar, se obțin izomeri cis, iar izomerii trans sunt obținuți pe părți opuse.
Hidrocarburi saturate- acestea sunt hidrocarburi ale căror molecule conțin doar legături (-legături) simple (single). Hidrocarburile saturate sunt alcanii și cicloalcanii.
Atomii de carbon din hidrocarburile saturate sunt în stare de hibridizare sp 3.
Alcani- hidrocarburi saturate, a căror compoziție este exprimată prin formula generală C n H 2n+2. Alcanii sunt hidrocarburi saturate.
Izomeri și omologi
| G | CH 4 metan |
||||
| CH3-CH3 etan |
|||||
| CH3-CH2-CH3 propan |
|||||
| CH3—(CH2)2—CH3 butan |
2-metilpropan |
||||
| CH3—(CH2)3—CH3 pentan |
2-metilbutan |
2,2-dimetilpropan |
|||
| CH3—(CH2)4—CH3 hexan |
2-metilpentan |
2,2-dimetilbutan |
2,3-dimetilbutan |
3-metilpentan |
|
| izomerii | |||||
Proprietățile fizice ale alcanilor
La temperatura camerei, C1-C4 sunt gaze, C5-C15 sunt lichide, C16 și următoarele sunt solide; insolubil în apă; densitate mai mică de 1 g/cm3; lichid - cu miros de benzină.
Pe măsură ce numărul de atomi de carbon dintr-o moleculă crește, punctul de fierbere crește.
Proprietățile chimice ale alcanilor
Activitate scăzută în condiții normale, nu reacționează cu soluții de acizi și alcaline, nu decolorează soluția de KMnO 4 și apa cu brom.
>Prepararea alcanilor
>>Cicloalcani- hidrocarburi saturate, a căror compoziție este exprimată prin formula C n H 2 n. Moleculele de cicloalcan conțin lanțuri de carbon închise (cicluri).
Izomeri și omologi
| G | Ciclopropan C3H6 sau |
||||
| Ciclobutan C4H8 sau |
Metilciclopropan |
||||
| Ciclopentan C5H10 sau |
Metilciclobutan |
1,1-dimetilciclopropan |
1,2-dimetilciclopropan |
Etilciclopropan |
|
| izomerii | |||||
Simplificat, ciclul hidrocarburilor este adesea descris ca un poligon obișnuit cu numărul adecvat de unghiuri.
Proprietățile fizice diferă puțin de cele ale alcanilor.
Proprietăți chimice
Cu excepția ciclopropanului și ciclobutanului, cicloalcanii, ca și alcanii, sunt inactivi în condiții normale.
Proprietăți generale ale cicloalcanilor (folosind ciclohexanul ca exemplu):
>Proprietăți speciale ale ciclopropanului și ciclobutanului (tendința pentru reacții de adiție):
Metode de obţinere a cicloalcanilor
Algoritm pentru compilarea denumirilor hidrocarburilor saturate
- Găsiți coloana vertebrală de carbon: este cel mai lung lanț de atomi de carbon.
- Numerotați atomii de carbon din lanțul principal, începând cu capătul cel mai apropiat de ramură.
- Indicați numărul atomului de carbon din lanțul principal care are un substituent și dați numele substituentului. Dacă există mai mulți substituenți, aranjați-i alfabetic. Înainte de numele substituenților identici, indicați numărul tuturor atomilor de carbon de care sunt legați și utilizați prefixe de multiplicare (di-, tri-, tetra-).
- Scrieți numele lanțului principal cu sufixul -an. Rădăcinile numelor lanțului principal: C 1 - met, C 2 - et, C 3 - prop, C 4 - dar, C 5 - pent, C 6 - hex, C 7 - hep, C 8 - okt, C 9 - non, Din 10 - dec. Denumirile de cicloalcani nesubstituiți sunt formate din denumirea hidrocarburii saturate cu adăugarea prefixului ciclo-. Dacă într-un cicloalcan există substituenți, atunci atomii de carbon din inel sunt numerotați de la cel mai simplu substituent (cel mai vechi, metil) la cel mai complex în cel mai scurt mod, iar pozițiile substituenților sunt indicate în același mod ca în alcani.
Sarcini și teste pe tema „Tema 1. „Hidrocarburi saturate”.”
- Hidrocarburi. Polimeri - Substanțe organice gradul 8–9
Lecții: 7 Teme: 9 Teste: 1
- - Omul în lumea substanțelor, materialelor și reacțiilor chimice, clasele 8–9
Lecții: 2 Teme: 6 Teste: 1
- Clasificarea substantelor - Clase de substanțe anorganice gradul 8–9
Lecții: 2 Teme: 9 Teste: 1
A. Având în vedere caracteristicile unei substanțe care participă la reacție (masă, volum, cantitate de substanță), trebuie să găsiți caracteristicile unei alte substanțe.Exemplu. Determinați masa de clor necesară pentru prima etapă de clorurare a 11,2 litri de metan.
Răspuns: m(CI2) = 35,5 g.
B. Calcule folosind regula raporturilor volumetrice ale gazelor.
Exemplu. Determinați ce volum de oxigen, măsurat în condiții normale (n.o.), va fi necesar pentru arderea completă a 10 m 3 de propan (n.o.).
Răspuns: V(O 2) = 50 m 3.După ce v-ați asigurat că tot ce aveți nevoie a fost stăpânit, treceți la finalizarea sarcinilor pentru subiectul 1. Vă dorim succes.
Lectură recomandată:- O. S. Gabrielyan şi alţii.Chimie clasa a X-a. M., Butarda, 2002;
- L. S. Guzey, R. P. Surovtseva, G. G. Lysova. Chimie clasa a XI-a. Butarda, 1999.
- G. G. Lysova. Note de bază și teste în chimia organică. M., Glik Plus LLC, 1999.
Hidrocarburile saturate sunt compuși care sunt molecule formate din atomi de carbon în stare de hibridizare sp 3. Ele sunt conectate între ele exclusiv prin legături sigma covalente. Denumirea de hidrocarburi „saturate” sau „saturate” provine de la faptul că acești compuși nu au capacitatea de a atașa niciun atom. Sunt extreme, complet saturate. Excepția sunt cicloalcanii.
Ce sunt alcanii?
Alcanii sunt hidrocarburi saturate, iar lanțul lor de carbon este deschis și constă din atomi de carbon legați între ei folosind legături simple. Nu conține alte legături (adică duble, ca alchene, sau triple, ca alchilii). Alcanii sunt numiți și parafine. Ei au primit această denumire deoarece parafinele binecunoscute sunt un amestec predominant din aceste hidrocarburi saturate C 18 -C 35 cu o inerție deosebită.
Informații generale despre alcani și radicalii lor
Formula lor: C n P 2 n +2, aici n este mai mare sau egal cu 1. Masa molară se calculează folosind formula: M = 14n + 2. Trăsătură caracteristică: terminațiile din numele lor sunt „-an”. Reziduurile moleculelor lor, care se formează ca urmare a înlocuirii atomilor de hidrogen cu alți atomi, se numesc radicali alifatici sau alchili. Sunt desemnați prin litera R. Formula generală a radicalilor alifatici monovalenți: C n P 2 n +1, aici n este mai mare sau egal cu 1. Masa molară a radicalilor alifatici se calculează cu formula: M = 14n + 1. O trăsătură caracteristică a radicalilor alifatici: terminațiile în numele „- nămol”. Moleculele de alcan au propriile lor caracteristici structurale:
- Legătura C-C este caracterizată printr-o lungime de 0,154 nm;
- Legătura C-H este caracterizată printr-o lungime de 0,109 nm;
- unghiul de legătură (unghiul dintre legăturile carbon-carbon) este de 109 grade și 28 de minute.

Alcanii încep seria omoloage: metan, etan, propan, butan și așa mai departe.
Proprietățile fizice ale alcanilor
Alcanii sunt substanțe incolore și insolubile în apă. Temperatura la care alcanii încep să se topească și temperatura la care fierb cresc în funcție de creșterea greutății moleculare și a lungimii lanțului de hidrocarburi. De la alcanii mai puțin ramificați la mai ramificați, punctele de fierbere și de topire scad. Alcanii gazoși pot arde cu o flacără albastru pal sau incolor și pot produce destul de multă căldură. CH 4 -C 4 H 10 sunt gaze care, de asemenea, nu au miros. C 5 H 12 - C 15 H 32 sunt lichide care au un miros specific. C 15 H 32 și așa mai departe sunt solide care sunt, de asemenea, inodore.
Proprietățile chimice ale alcanilor
Acești compuși sunt inactivi din punct de vedere chimic, ceea ce poate fi explicat prin rezistența legăturilor sigma greu de rupere - C-C și C-H. De asemenea, merită luat în considerare faptul că legăturile C-C sunt nepolare, iar legăturile C-H sunt polare scăzute. Acestea sunt tipuri de legături cu polarizare scăzută aparținând tipului sigma și, în consecință, este cel mai probabil să fie rupte printr-un mecanism omolitic, în urma căruia se vor forma radicali. Astfel, proprietățile chimice ale alcanilor sunt limitate în principal la reacțiile de substituție radicală.

Reacții de nitrare
Alcanii reacţionează numai cu acidul azotic cu o concentraţie de 10% sau cu oxidul de azot tetravalent în mediu gazos la o temperatură de 140°C. Reacția de nitrare a alcanilor se numește reacția Konovalov. Ca urmare, se formează compuși nitro și apă: CH 4 + acid azotic (diluat) = CH 3 - NO 2 (nitrometan) + apă.
Reacții de ardere
Hidrocarburile saturate sunt foarte des folosite drept combustibil, ceea ce se justifică prin capacitatea lor de a arde: C n P 2n+2 + ((3n+1)/2) O 2 = (n+1) H 2 O + n CO 2.
Reacții de oxidare
Proprietățile chimice ale alcanilor includ și capacitatea lor de a se oxida. În funcție de condițiile care însoțesc reacția și de modul în care acestea sunt modificate, din aceeași substanță se pot obține diferiți produse finite. Oxidarea ușoară a metanului cu oxigen în prezența unui catalizator care accelerează reacția și la o temperatură de aproximativ 200 ° C poate duce la următoarele substanțe:
1) 2CH 4 (oxidare cu oxigen) = 2CH 3 OH (alcool - metanol).
2) CH 4 (oxidare cu oxigen) = CH 2 O (aldehidă - metanal sau formaldehidă) + H 2 O.
3) 2CH 4 (oxidare cu oxigen) = 2HCOOH (acid carboxilic - metan sau formic) + 2H 2 O.

De asemenea, oxidarea alcanilor poate fi realizată într-un mediu gazos sau lichid cu aer. Astfel de reacții duc la formarea de alcooli grași superiori și acizii corespunzători.
Relația cu căldura
La temperaturi care nu depășesc +150-250°C, întotdeauna în prezența unui catalizator, are loc o rearanjare structurală a substanțelor organice, care constă într-o modificare a ordinii de conectare a atomilor. Acest proces se numește izomerizare, iar substanțele rezultate în urma reacției se numesc izomeri. Astfel, din butan normal se obține izomerul acestuia - izobutan. La temperaturi de 300-600°C și prezența unui catalizator, legăturile C-H sunt rupte cu formarea de molecule de hidrogen (reacții de dehidrogenare), molecule de hidrogen cu închiderea lanțului de carbon într-un ciclu (reacții de ciclizare sau aromatizare a alcanilor) :
1) 2CH4 = C2H4 (etenă) + 2H2.
2) 2CH4 = C2H2 (etina) + 3H2.
3) C7H16 (heptan normal) = C6H5 - CH3 (toluen) + 4H2.

Reacții de halogenare
Astfel de reacții presupun introducerea de halogeni (atomii lor) în molecula unei substanțe organice, având ca rezultat formarea unei legături C-halogen. Când alcanii reacţionează cu halogenii, se formează derivaţi de halogen. Această reacție are caracteristici specifice. Se procedează după un mecanism radical, iar pentru a-l iniția este necesar să expunem amestecul de halogeni și alcani la radiații ultraviolete sau pur și simplu să-l încălzim. Proprietățile alcanilor permit reacției de halogenare să continue până când se obține înlocuirea completă cu atomi de halogen. Adică, clorurarea metanului nu se va încheia într-o singură etapă și producția de clorură de metil. Reacția va merge mai departe, se vor forma toți produșii de substituție posibili, începând cu clormetan și terminând cu tetraclorura de carbon. Expunerea altor alcani la clor în aceste condiții va avea ca rezultat formarea diferiților produși care rezultă din înlocuirea hidrogenului la diferiți atomi de carbon. Temperatura la care are loc reacția va determina raportul dintre produsele finali și viteza de formare a acestora. Cu cât lanțul de hidrocarburi al alcanului este mai lung, cu atât reacția va fi mai ușoară. În timpul halogenării, atomul de carbon cel mai puțin hidrogenat (terțiar) va fi înlocuit mai întâi. Cel primar va reacționa după toate celelalte. Reacția de halogenare va avea loc în etape. În prima etapă, doar un atom de hidrogen este înlocuit. Alcanii nu interacționează cu soluțiile de halogen (apa cu clor și brom).

Reacții de sulfoclorurare
Proprietățile chimice ale alcanilor sunt completate și de reacția de sulfoclorurare (numită reacție Reed). Când sunt expuși la radiații ultraviolete, alcanii sunt capabili să reacționeze cu un amestec de clor și dioxid de sulf. Ca rezultat, se formează acid clorhidric, precum și un radical alchil, care adaugă dioxid de sulf. Rezultă un compus complex care devine stabil datorită captării unui atom de clor și distrugerii moleculei următoare: R-H + SO 2 + Cl 2 + radiația ultravioletă = R-SO 2 Cl + HCl. Clorurile de sulfonil formate ca rezultat al reacției sunt utilizate pe scară largă în producerea de agenți tensioactivi.
Alcanii sunt obținuți din produse petroliere, gaze naturale și cărbune. Utilizarea principală a alcanilor este ca combustibil. Substanțele sunt, de asemenea, folosite pentru a face solvenți, cosmetice și asfalt.
Descriere
Alcanii sunt o clasă de hidrocarburi saturate sau saturate. Aceasta înseamnă că moleculele de alcan conțin numărul maxim de atomi de hidrogen. Formula generală a compuşilor din seria omoloagă de alcani este C n H 2n+2. Numele substanțelor sunt compuse din cifre grecești și sufixul -an.
Proprietățile fizice și chimice ale alcanilor depind de structura lor. Pe măsură ce numărul de atomi de carbon dintr-o moleculă crește, are loc o tranziție de la substanțele gazoase la compușii solizi.
Starea fizică a alcanilor în funcție de numărul de atomi de carbon:
- C1-C4- gaze;
- De la 5 la 15- lichide;
- De la 16 - De la 390- solide.
Gazele ard cu o flacără albastră, eliberând o cantitate mare de căldură. Alcanii care conțin 18-35 atomi de carbon sunt substanțe ceroase, moi. Lumânările cu parafină sunt făcute din amestecul lor.

Orez. 1. Lumanari cu parafina.
Odată cu creșterea greutății moleculare în seria omoloagă, punctele de topire și de fierbere cresc.
Aplicație
Alcanii sunt izolați din minerale - petrol, gaz, cărbune. În diferite etape de procesare, se obține benzină, kerosen și păcură. Alcanii sunt folosiți în medicină, cosmetologie și construcții.

Orez. 2. Uleiul conține alcani lichizi.
Tabelul descrie principalele domenii de aplicare ale hidrocarburilor saturate.
|
Regiune |
Ce se foloseste |
Cum se utilizează |
|
Industria energetică |
Benzină, kerosen, păcură |
Ca rachetă și combustibil pentru motor |
|
Alcani gazoși |
Ca gaz menajer pentru gătit |
|
|
Industria chimica |
eter de petrol (un amestec de izopentani și izohexani), |
Productie de solventi, uleiuri lubrifiante, impregnari |
|
Producția de vaselină (un amestec de alcani lichizi), vaselina (un amestec de alcani lichizi și solizi), lumânări, detergenți, lacuri, emailuri, săpun. Ca impregnare pentru chibrituri. Utilizare în producția de acizi organici |
||
|
Alcani clorurati |
Producerea de alcooli, aldehide, acizi |
|
|
Cosmetologie |
Vaselina, vaselina |
Producția de unguente |
|
Ca propulsori pentru fabricarea de aerosoli |
||
|
Producția de produse cosmetice hidratante |
||
|
Constructie |
Gudronul (gudronul) este produsul final al rafinării petrolului, care conține un amestec de alcani, cicloalcani, arene, metale, nemetale |
Pentru producția de drumuri asfaltate |
|
Industria hârtiei și a celulozei |
Ca impregnare pentru hârtie de ambalare |
|
|
Industria alimentară |
Producția de gumă de mestecat |

Orez. 3. Gudron.
Alcanii sunt utilizați la fabricarea cauciucului, a țesăturilor sintetice, a materialelor plastice și a agenților tensioactivi. Propanul și butanul în formă lichefiată sunt utilizate pentru reumplerea butelilor de stingere a incendiilor.
Ce am învățat?
Am aflat pe scurt despre aplicațiile alcanilor. Hidrocarburile saturate în stare gazoasă, lichidă și solidă sunt utilizate în industria chimică, alimentară, hârtie, industria energetică, cosmetologie și construcții. Alcanii sunt utilizați pentru a produce solvenți, vopsele, lacuri, săpunuri, lumânări, unguente și asfalt. Benzina, kerosenul și păcura, constând din alcani lichizi, sunt folosite drept combustibil. Alcanii gazoși sunt folosiți în viața de zi cu zi și pentru producerea de aerosoli. Principalele surse de alcani sunt petrolul, gazele naturale și cărbunele.
Conținutul articolului
ALCANI ŞI CICLOALCANI– hidrocarburi în care toți atomii de carbon sunt legați între ei și de atomii de hidrogen prin legături simple (single). Alcani (sinonime - hidrocarburi saturate, hidrocarburi saturate, parafine) - hidrocarburi cu formula generala C n H 2 n+2, unde n– numărul de atomi de carbon. Polietilena familiară are aceeași formulă, doar dimensiunea n este foarte mare și poate ajunge la zeci de mii. În plus, polietilena conține molecule de diferite lungimi. În cicloalcani, atomii de carbon formează un lanț închis; dacă există un ciclu, formula cicloalcanului este C n H 2 n .
În funcție de ordinea conexiunii atomilor de carbon într-un lanț, alcanii sunt împărțiți în liniari și ramificați. În consecință, pentru alcanii cu nі 4 este posibil să existe mai multe substanțe cu aceeași formulă. Astfel de substanțe se numesc izomeri (din greacă. isis– egal, identic și meros – share, part.
Denumiri de alcani.
Cuvântul „alcan” este de aceeași origine cu „alcool” ( vezi mai jos). Termenul învechit „parafină” provine din latinescul parum – puțin, nesemnificativ și affinis – înrudit; parafinele au reactivitate scăzută față de majoritatea reactivilor chimici. Multe parafine sunt omologi; în seria omoloagă de alcani, fiecare membru ulterior diferă de cel anterior printr-un grup metilen CH2. Termenul provine din grecescul homologos – corespunzător, asemănător.
Nomenclatură (din lat. nomenclatură– listă de nume) denumirile alcanilor sunt construite după anumite reguli, care nu sunt întotdeauna clare. Deci, dacă există diverși substituenți într-o moleculă de alcan, atunci în numele alcanului sunt enumerați în ordine alfabetică. Cu toate acestea, această ordine poate varia în diferite limbi. De exemplu, hidrocarbura CH 3 –CH(CH 3)–CH(C 2 H 5)–CH 2 –CH 2 –CH 3 în conformitate cu această regulă va fi numită 2-metil-3-etilhexan în rusă, iar în engleză 3-etil-2-metilhexan...
În conformitate cu denumirea hidrocarburii, radicalii alchil mai sunt numiți: metil (CH 3 -), etil (C 2 H 5 -), izopropil (CH 3) 2 CH-, marţi-butil C2H5-CH (CH3)-, freacă-butil (CH3)3C- etc. Radicalii alchil sunt incluși ca un întreg în compoziția multor compuși organici; în stare liberă, aceste particule cu un electron nepereche sunt extrem de active.
Unii izomeri ai alcanilor au, de asemenea, nume banale ( cm. DENUMIRE DE SUBSTANȚE TRIVIALE, de exemplu izobutan (2-metilpropan), izooctan (2,2,4-trimetilpentan), neopentan (2,3-dimetilpropan), squalan (2,6,10,15,19,23-hexametiltetracosan), al cărui numele provine din latină scual– rechin (un derivat nesaturat al squalan – squalen, un compus important pentru metabolism, a fost descoperit pentru prima dată în ficatul unui rechin). Numele trivial pentru radicalul pentil (C5H11) este amil. Vine din greacă. amilon– amidon: pe vremuri, alcoolul izoamil C 5 H 11 OH (3-metilbutanol-1) era numit „alcool amilic de fermentație”, deoarece formează baza uleiului de fusel și se formează ca urmare a fermentației. a substanțelor zaharoase - produse ale hidrolizei amidonului.
Cel mai simplu membru al seriei cicloalcanilor C n H 2 n– ciclopropan ( n= 3). Omologii săi sunt numiți la fel ca alcanii cu adăugarea prefixului „ciclo” (ciclobutan, ciclopentan etc.). În cicloalcani, izomeria este posibilă datorită prezenței grupărilor alchil laterale și a locației acestora în inel. De exemplu, ciclohexanul, metilciclopentanul, 1,1-, 1,2- şi 1,3-dimetilciclobutanii, 1,1,2- şi 1,2,3-trimetilciclopropanii sunt izomeri.
Numărul de izomeri alcani crește brusc odată cu creșterea numărului de atomi de carbon. Denumirile unor alcani, precum și numărul teoretic al posibililor izomeri ai acestora, sunt date în tabel.
| Formulă | Nume | Numărul de izomeri | Formulă | Nume | Numărul de izomeri |
| CH 4 | Metan | 1 | C 11 N 24 | Undekan | 159 |
| C2H6 | etan | 1 | C 12 N 26 | Dodecan | 355 |
| C3H8 | propan | 1 | C 13 N 28 | Tridecan | 802 |
| C4H10 | Butan | 2 | C 14 N 30 | tetradecan | 1858 |
| C5H12 | Pentan | 3 | C 15 N 32 | Pentadecan | 4347 |
| C6H14 | hexan | 5 | C 20 N 42 | Eikosan | 366319 |
| C7H16 | heptan | 9 | C 25 N 52 | Pentacosan | 36797588 |
| C8H18 | Octan | 18 | C 30 N 62 | Triacontan | 4111846763 |
| C9H20 | Nonan | 35 | C 40 N 82 | Tetracontan | 62481801147341 |
| C10H22 | Decan | 75 | C 100 N 202 | hectan | aproximativ 5.921 10 39 |
Înțelegerea majorității numelor de nomenclatură ale hidrocarburilor saturate nu este foarte dificilă nici măcar pentru cei care nu au studiat greaca într-un gimnaziu clasic. Aceste nume provin de la cifre grecești cu adăugarea sufixului -an. Este mai dificil cu primii membri ai seriei: ei nu folosesc numere, ci alte rădăcini grecești asociate cu numele alcoolilor sau acizilor corespunzători. Acești alcooli și acizi erau cunoscuți cu mult înainte de descoperirea alcanilor corespunzători; un exemplu este alcoolul etilic și etanul (obținute abia în 1848).
Metanul (precum și metanolul, metilul, metilenul etc.) au o rădăcină comună „met”, care în chimie denotă o grupare care conține un atom de carbon: metil CH 3, metilen (metilidenă) CH 2, metină (metilidină) CH. Din punct de vedere istoric, prima astfel de substanță a fost alcoolul metilic (cunoscut și sub numele de lemn), metanolul, care a fost obținut anterior prin distilarea uscată a lemnului. Numele său provine de la cuvintele grecești methy - a intoxica vinul și hile - pădure (ca să spunem așa, „vin de lemn”). Cel mai uimitor lucru aici este că metanul, ametistul și mierea au o rădăcină comună! În cele mai vechi timpuri, pietrele prețioase erau înzestrate cu proprietăți magice (și mulți încă mai cred în acest lucru). Astfel, se credea că pietrele mov frumoase protejează împotriva intoxicației, mai ales dacă din această piatră se făcea o cană de băut. Împreună cu prefixul negativ, sa dovedit ametistos - contracarând intoxicația. Cuvântul miere, se pare, este prezent în aproape toate limbile europene: engleză. mied - miere (sub formă de băutură), german Met (în germană veche metu), mede olandez, mjöd suedez, mjød danez, medus lituanian și leton, ca să nu mai vorbim de limbile slave. Toate aceste cuvinte, inclusiv grecescul, provin din indo-europeanul medhu, care înseamnă băutură dulce. Coniacul grecesc Metaxa nu este departe de ei, deși nu este deloc dulce.
Etanul (precum și eterul, etanolul, alcoolul, alcanul) au o origine comună. Filosofii greci antici au folosit cuvântul aither pentru a descrie o anumită substanță care pătrunde în cosmos. Când alchimiştii în secolul al VIII-lea. Ei au obținut un lichid ușor de evaporat din alcool de vin și acid sulfuric, acesta a fost numit eter sulfuric. În secolul 19 a aflat că eterul sulfuric (în engleză eter) aparține așa-numiților eteri și conține un grup de doi atomi de carbon - la fel ca alcoolul etilic (etanol); acest grup a fost numit etil. Astfel, denumirea substanței „eter etilic” (C 2 H 5 –O–C 2 H 5) este în esență „ulei de ulei”.
Numele de etan provine de la „etil”. Unul dintre denumirile pentru etanol, alcool, este de aceeași origine cu cuvântul alcan (de asemenea, alchenă, alchină, alchil). În arabă, al-kohl înseamnă pulbere, pulbere, praf. La cea mai mică suflare se ridică în aer, la fel ca vaporii de vin - „alcoolul vinului”, care în timp s-a transformat pur și simplu în alcool.
De ce există un „t” în „etan” și „etanol” și „f” în „eter”? La urma urmei, în engleză, spre deosebire de rusă, cuvintele „eter” și „etil” au ortografii și sunete similare. Combinația th se întoarce la litera grecească q (theta); în limba rusă până în 1918, litera „fita” avea același stil, care, totuși, era pronunțată ca „f” și era folosită cu scopul exclusiv de a distinge cuvintele în care această literă provine din grecescul q și 247 („ fi”). În limbile vest-europene, greacă. j a mers la ph și q la th. În limba rusă, multe cuvinte conțin „fita” încă din secolul al XVIII-lea. a fost înlocuită cu litera „f”: teatru în loc de „qeaftr”, matematică în loc de „maqematics”, teorie în loc de „qeory”... În acest sens, este interesant că în dicționarul lui Dahl, publicat în 1882, este eqir scris, iar în dicționarul enciclopedic al lui Brockhaus și Efron (1904) – „eter”.
Apropo, esterii în limbile occidentale sunt esteri, nu eter. Dar cuvântul „ester” nu există în limba rusă, așa că ochii oricărui chimist sunt răniți de traducerea analfabetă a poliesterului englez pe etichetele produselor textile ca „poliester” în loc de „poliester”, „fibră de poliester” (poliester). includ, de exemplu, lavsan, terylene, dacron).
Denumirile „propan” și „butan” provin de la denumirile acizilor corespunzători – propionic și butanoic (butiric). Acidul propionic este „primul” (adică cel mai scurt lanț) găsit în grăsimi ( cm. GRASIMI SI ULEIURI), iar numele sau este derivat din limba greaca. protos- în primul rând și pion- gras. Butan și acid butanoic butiric acid) – din greacă. butiron- ulei; În rusă, butirații sunt săruri și esteri ai acidului butiric. Acest acid este eliberat atunci când uleiul devine rânced.
În plus, începând cu pentan, numele sunt derivate din cifre grecești. O excepție rară este cetanul, unul dintre denumirile pentru hexadecanul C16. Acest cuvânt provine de la denumirea de alcool cetilic, care a fost obținut în 1823 de chimistul francez Michel Eugene Chevreul. Chevreul a izolat această substanță din spermaceti, o substanță ceară din capul cașalotului. Cuvântul spermaceti provine din grecescul sperma - sămânță și ketos - animal marin mare (balenă, delfin). Din scrierea latină a celui de-al doilea cuvânt (cetus) provine alcoolul cetilic C 16 H 33 OH (hexadecanol) și cetanul.
În limba rusă există multe cuvinte cu aceleași rădăcini ca și alcanii: Pentagon, heptacord (scara sonoră de 7 trepte), dodecafonie (metoda de compunere muzicală), octava, decima și undecima (intervale muzicale), octet și nonet (ansambluri de 8 și 9 muzicieni), pentode, hexode și heptode (tuburi radio); hexametru (metru poetic), octaedru, deceniu, decan, hectar, octombrie, decembrie etc. și așa mai departe.
Alcanul cu cele mai lungi molecule a fost sintetizat de chimiștii englezi în 1985. Acesta este nonacontatrictan C 390 H 782, care conține un lanț de 390 de atomi de carbon. Cercetătorii au fost interesați de modul în care astfel de lanțuri lungi s-ar împacheta în timpul cristalizării (lanțurile de hidrocarburi flexibile se pot plia cu ușurință).
Numărul de izomeri ai alcanilor.
Problema numărului posibil teoretic de izomeri ai alcanilor a fost rezolvată pentru prima dată de matematicianul englez Arthur Cayley (1821–1895), unul dintre fondatorii unei ramuri importante a matematicii - topologia (în 1879 a publicat primul articol despre faimosul „ problema celor patru culori”: sunt suficiente pentru a colora vreo carte geografică; această problemă a fost rezolvată abia în 1976). S-a dovedit că nu există o formulă prin care se poate utiliza numărul de atomi de carbon dintr-un alcan C n H 2 n+2 calculează numărul izomerilor săi. Există doar așa-numitele formule recurente (din latină recidive– revenire), care vă permit să calculați numărul de izomeri n al-lea membru al seriei, dacă numărul de izomeri ai membrului anterior este deja cunoscut. Prin urmare, calcule pentru mari n au fost obținute relativ recent folosind computere și reduse la hidrocarbură C 400 H 802; pentru aceasta, ținând cont de izomerii spațiali, s-a obținut o valoare greu de imaginat: 4.776·10 199. Și pornind de la alcanul C 167 H 336, numărul de izomeri depășește numărul de particule elementare din partea vizibilă a Universului, care este estimat la 1080. Numărul de izomeri indicat în tabel pentru majoritatea alcanilor va crește semnificativ dacă luăm în considerare și moleculele simetrice în oglindă - stereoizomerii ( cm. IZOMERISME OPTICĂ): pentru heptan - de la 9 la 11, pentru decan - de la 75 la 136, pentru eicosan - de la 366.319 la 3.396.844, pentru hectan - de la 5.921 10 39 la 1.373 10 46, etc.
Din punctul de vedere al unui chimist, numărul de izomeri structurali ai hidrocarburilor saturate prezintă interes practic doar pentru primii membri ai seriei. Chiar și pentru un alcan relativ simplu care conține doar o duzină și jumătate de atomi de carbon, numărul copleșitor de izomeri nu a fost obținut și este puțin probabil să fie sintetizați vreodată. De exemplu, ultimii dintre cei 75 de izomeri ai decanului posibil teoretic au fost sintetizați abia în 1968. Și acest lucru a fost făcut în scopuri practice - pentru a avea un set mai complet de compuși standard prin care diferite hidrocarburi, de exemplu, cele găsite în ulei, pot fi identificat. Apropo, toți cei 18 izomeri octanici posibili au fost găsiți în diferite tipuri de ulei.
Dar cel mai interesant lucru este că, începând cu heptadecanul C 17 H 36, la început doar o parte din numărul teoretic posibil de izomeri, apoi mulți și, în final, aproape toți sunt un exemplu izbitor de „chimie a hârtiei”, adică. nu poate exista în realitate. Faptul este că, pe măsură ce numărul de atomi de carbon din moleculele de izomeri ramificati crește, apar probleme serioase de împachetare spațială. La urma urmei, matematicienii au tratat atomii de carbon și hidrogen ca puncte, când de fapt au o rază finită. Astfel, o „bilă” de metan are 4 atomi de hidrogen pe „suprafața” sa, care sunt așezați liber pe ea. În neopentan C(CH 3) 4 există deja 12 atomi de hidrogen pe „suprafață”, situați mult mai aproape unul de celălalt; dar mai este loc pentru a le pune. Dar pentru alcanul 4 (C 17 H 36), nu există suficient spațiu pe suprafață pentru a găzdui toți cei 36 de atomi de hidrogen din 12 grupări metil; Acest lucru este ușor de verificat dacă desenați o imagine plată (sau, și mai bine, faceți un model tridimensional din plastilină și chibrituri) pentru izomeri similari, menținând constanta lungimii legăturilor C–C și C–H și toate unghiurile dintre ele). Odată cu creșterea n probleme de plasare apar și pentru atomii de carbon. Ca rezultat, în ciuda faptului că numărul de izomeri posibili cu creștere n crește foarte repede, ponderea izomerilor „de hârtie” crește mult mai repede. O evaluare pe computer a arătat că ca n raportul dintre numărul de izomeri cu adevărat posibili și numărul celor „de hârtie” se apropie rapid de zero. De aceea, calculul numărului exact de izomeri ai hidrocarburilor saturate pentru mari n, care odată a stârnit un interes considerabil, are acum doar semnificație teoretică pentru chimiști.
Structura și proprietățile fizice ale alcanilor.
Alcanii au patru orbiti hibrizi sp 3 ai atomului de carbon ( cm. ORBITALE) sunt îndreptate spre vârfurile tetraedrului cu un unghi între ele de aproximativ 109°28" - în acest caz respingerea dintre electroni și energia sistemului sunt minime. Ca urmare a suprapunerii acestor orbitali. unul cu celălalt, precum și cu s-orbitalii atomilor de hidrogen formează legături s C–C și C–H. Aceste legături din moleculele de alcan sunt covalente nepolare sau cu polar scăzut.
Alcanii sunt împărțiți în atomi de carbon primari (sunt legați doar de un atom de C vecin), secundari (legați la doi atomi de C), terțiari (legați la trei atomi de C) și cuaternari (legați la patru atomi de C). Astfel, în 2,2-dimetil-3-metilpentanul CH 3 –C(CH 3) 2 –CH(CH 3) – CH 2 –CH 3 există un atomi de carbon cuaternar, unul terțiar, unul secundar și cinci primari. Diferitele medii ale atomilor de carbon afectează foarte mult reactivitatea atomilor de hidrogen asociati acestora.
Dispunerea spațială a orbitalilor sp 3 duce, pornind de la propan, la o configurație în zig-zag a lanțurilor de carbon. În acest caz, este posibilă rotația fragmentelor moleculare în jurul legăturilor C-C (într-o moleculă de etan la 20 ° C - cu o viteză de milioane de rotații pe secundă!), ceea ce face ca moleculele de alcani superiori să fie flexibile. Îndreptarea unor astfel de lanțuri are loc, de exemplu, la întinderea polietilenei, care constă dintr-un amestec de alcani cu lanțuri lungi.Moleculele de alcani interacționează slab între ele, prin urmare alcanii se topesc și fierb la temperaturi mult mai scăzute decât substanțele similare cu molecule polare. Primii 4 membri ai seriei omoloage de metan sunt gaze în condiții normale; propanul și butanul sunt ușor lichefiați la presiune scăzută (un amestec lichid propan-butan este conținut în buteliile de gaz de uz casnic). Omologuri superioare sunt lichide cu miros de benzină sau solide care sunt insolubile în apă și plutesc pe suprafața acesteia. Punctele de topire și de fierbere ale alcanilor cresc odată cu creșterea numărului de atomi de carbon din moleculă, în timp ce creșterea temperaturii încetinește treptat, de exemplu, C 100 H 202 se topește la 115 ° C, C 150 H 302 - la 123 ° C. Topire iar punctele de fierbere pentru primii 25 de alcani sunt date în tabel - este clar că pornind de la octadecan, alcanii sunt solide.
| Masa. TEMPERATURILE DE TOPIRE ȘI DE FIERBERE A ALCANII | ||
| alcan | T pl | T balot |
| Metan | –182,5 | –161,5 |
| etan | –183,3 | –88,6 |
| propan | –187,7 | –42,1 |
| Butan | –138,4 | –0,5 |
| Pentan | –129,7 | 36,1 |
| hexan | –95,3 | 68,7 |
| heptan | –90,6 | 98,4 |
| Octan | –56,8 | 125,7 |
| Nonan | –51,0 | 150,8 |
| Decan | –29,7 | 174,1 |
| Undekan | –25,6 | 195,9 |
| Dodecan | –9,6 | 216,3 |
| Tridecan | –5,5 | 235,4 |
| tetradecan | +5,9 | 253,7 |
| Pentadecan | +9,9 | 270,6 |
| hexadecan | 18,2 | 286,8 |
| heptadecan | 22,0 | 301,9 |
| Octadecan | 28,2 | 316,1 |
| nonadecan | 32,1 | 329,7 |
| Eikosan | 36,8 | 342,7 |
| Geneikozan | 40,5 | 356,5 |
| Docozan | 44,4 | 368,6 |
| Tricozan | 47,6 | 378,3 |
| Tetracosan | 50,9 | 389,2 |
| Pentacosan | 53,7 | 399,7 |
Prezența unei ramuri în lanț modifică dramatic proprietățile fizice, în special punctul de topire. Deci, dacă hexanul are o structură normală ( n-hexan) se topește la –95,3° C, apoi izomerul său 2-metilpentan se topește la –153,7° C. Acest lucru se datorează dificultății de a împacheta moleculele ramificate în timpul cristalizării lor. Ca urmare, alcanii cu ramuri de lanț nu cristalizează la răcirea rapidă, ci se transformă în starea sticloasă a unui lichid suprarăcit ( cm. STICLĂ). De exemplu, dacă o fiolă subțire de pentan este scufundată în azot lichid (temperatura -196 ° C), substanța se va transforma într-o masă albă asemănătoare zăpezii, în timp ce izopentanul (2-metilbutan) se solidifică într-o „sticlă” transparentă.
O metodă originală de separare a acestora se bazează pe diferența de formă geometrică a alcanilor liniari și ramificati: cristalele de uree au canale în care alcanii cu catenă dreaptă pot încadra, dar cei ramificați nu.
Cicloalcani cu n= 2, 3 – gaze, mai mare – lichide sau solide. Cel mai mare ciclu pe care chimiștii l-au putut sintetiza este ciclooctaoctacontadictanul C 288 H 576. Diferitele forme ale moleculelor de cicloalcan cu numere par și impar de atomi de carbon în moleculă duc la un efect puternic par-impar în ceea ce privește punctul de topire, așa cum se poate observa din tabel. Acest efect se explică prin diferența de „conveniență” de ambalare a moleculelor de diferite forme într-un cristal: cu cât împachetarea este mai compactă, cu atât cristalul este mai puternic și cu atât punctul său de topire este mai mare. De exemplu, ciclododecanul se topește cu aproape 70° mai sus decât cel mai apropiat omolog al său, cicloundecanul. Desigur, contează și masa moleculei: moleculele ușoare se topesc la o temperatură mai scăzută.
| C3H6 | –127,5 |
| C4H8 | –50 |
| C5H10 | –93,9 |
| C6H12 | +6,5 |
| C7H14 | –12 |
| C8H16 | 14,3 |
| S9H18 | 9,7 |
| C10N20 | 10,8 |
| C 11 N 22 | –7,2 |
| C12H24 | 61,6 |
| C 13 N 26 | 23,5 |
| C 14 N 28 | 54 |
| C15N30 | 62,1 |
Ușurința de rotație în jurul legăturii C–C duce la faptul că moleculele de cicloalcani nu sunt plane (cu excepția ciclopropanului), în acest fel evită distorsiunile puternice ale unghiurilor de legătură. Astfel, la ciclohexan și omologii săi superiori unghiurile de legătură sunt relaxate și apropiate de tetraedric (109°), în timp ce într-un hexagon unghiurile sunt de 120°, într-un octogon - 135° etc. Atomii de carbon individuali din astfel de cicloalcani nu ocupă o poziție fixă rigid: inelul pare să fie într-o mișcare constantă ca undă. Astfel, o moleculă de ciclohexan poate fi sub forma unor structuri geometrice diferite (conformers) care se pot transforma unele în altele (inversie de ciclu). Datorită asemănării lor externe, au fost numite „cadă” și „scaun” (în literatura engleză, o „cadă” se numește „barcă”):
Forma scaunului este mai stabilă; La temperaturi obișnuite, 99,9% din ciclohexan există sub formă de scaun mai stabil. Tranziția între două forme are loc printr-o „conformație de răsucire” intermediară (din engleză. răsucire- răsucire).
În ciclopropan, unghiul scade de la 108° la 60°, rezultând legături de tensiune ridicată și „îndoiți” care sunt intermediare între legăturile s și p normale; Datorită formei lor, aceste legături sunt numite legături „banane”. În acest caz, orbitalii sp 3 ai atomilor de carbon se suprapun doar parțial. Rezultatul este dualitatea proprietăților chimice ale ciclopropanului. Pe de o parte, înlocuirea atomilor de hidrogen este posibilă în ea (o reacție tipică alcanilor), pe de altă parte, este posibilă adăugarea cu deschidere a inelului (reacție tipică alchenelor, de exemplu: ciclo-C3H6 + Br2® BrCH2CH2CH2Br).
Cicloalcanii cu două inele și un atom de carbon comun se numesc spiroalcani. Dacă există mai mult de doi atomi de carbon comuni, atunci se formează bicicloalcani, tricicloalcani etc.. Ca urmare a unei astfel de „reticulare” a mai multor cicluri simultan, chimiștii au reușit să obțină hidrocarburi, a căror structură spațială corespunde diferitelor poliedre: tetraedru, cub, prismă etc. Derivații biciclici ciclohexanul se găsesc în uleiurile esențiale, rășina de conifere și terebentina. Un ciclu de șase și cinci atomi de carbon se găsește în camfor, colesterol, zaharină, piperină (oferă gustul iute piperului negru), baze azotate - nucleotide și alți compuși (unii atomi de carbon din cicluri pot fi legați prin legături duble). , iar unii sunt substituiți cu alți atomi, cum ar fi zaharina). Un ciclu de 17 atomi de carbon (doi dintre ei legați printr-o legătură dublă) este conținut în civeton, o substanță mirositoare, o componentă a moscului, care este folosită în parfumerie. Frumoasa moleculă de adamantan conține trei inele cu șase membri, iar structura sa corespunde rețelei cristaline a diamantului. Structura adamantanului se găsește în medicamentul antiviral rimantadină, în hexametilentetramină (în acest din urmă compus, 4 atomi de carbon sunt înlocuiți cu atomi de azot, care sunt legați între ei prin punți de metilen – CH 2 –). Mai jos sunt structurile unor cicloalcani, ale căror molecule au mai mult de un inel conectat diferit.
Biciclodecan (tetrahidronaftalină, decalină)
Adamantan
Proprietățile chimice ale alcanilor.
Alcanii sunt compușii organici cel mai puțin activi din punct de vedere chimic. Toate legăturile C-C și C-H din alcani sunt simple, deci alcanii sunt incapabili de reacții de adiție. Alcanii se caracterizează prin reacții de înlocuire a atomilor de hidrogen cu alți atomi și grupuri de atomi. Astfel, când metanul este clorurat, se formează clorură de metil CH3CI, clorură de metilen CH2CI2, triclormetan (cloroform) CHCI3 şi tetraclorura de carbon (tetraclorura de carbon) CCl4. Aceste reacții urmează un mecanism în lanț cu formarea intermediară a radicalilor liberi.
La clorurarea alcanilor, începând cu propanul, primul atom de clor poate înlocui diferiți atomi de hidrogen. Direcția de substituție depinde de puterea legăturii C–H: cu cât este mai slabă, cu atât mai rapidă este înlocuirea acestui atom particular. Legăturile primare C–H sunt de obicei mai puternice decât cele secundare, iar cele secundare sunt mai puternice decât cele terțiare. Ca urmare, clorurarea la 25° C de-a lungul legăturii secundare (CH 3) 2 CH–H are loc de 4,5 ori mai rapid decât prin legătura primară C 2 H 5 –H, iar legătura terțiară (CH 3) 3 C–H – de 6,7 ori mai rapid. Reactivitatea diferită a atomilor de hidrogen primari, secundari și terțiari poate avea ca rezultat predominarea doar a unuia dintre mai mulți produși de clorurare posibili. De exemplu, când 2,3-dimetilbutanul este clorurat într-o soluție de disulfură de carbon (CS 2), se formează 95% din derivatul 2-clor și numai 5% din derivatul 1-clor, adică. de 19 ori mai puțin. Dacă luăm în considerare că în alcanul original există de 6 ori mai mulți atomi de hidrogen primari decât cei terțiari, atunci raportul reactivității lor va fi și mai mare (19 ґ 6 = 114). Disulfura de carbon ca solvent reduce reactivitatea atomilor de clor și, în consecință, îi crește selectivitatea. Scăderea temperaturii funcționează în același mod.
Atomii de brom sunt mai puțin activi; Energia de activare vizibilă a acestei reacții duce la faptul că bromurarea alcanilor, deși are loc printr-un mecanism în lanț, este mult mai lentă decât clorurarea și numai la temperaturi ridicate sau la lumină. Activitatea mai scăzută a atomilor de brom duce, de asemenea, la o selectivitate crescută a bromurarii. Astfel, dacă viteza relativă de bromurare fotochimică a etanului la 40°C este considerată egală cu 1, atunci viteza de bromurare a propanului (la atomul de H secundar) va fi deja de 220 în aceleași condiții, iar viteza de bromurare a izobutanul (la atomul de H terțiar) va fi de 19.000
Atomii de iod sunt cei mai puțin activi, de aceea reacția de iodare a alcanilor RH + I 2 ® RI + HI este endotermă, posibilă doar la temperaturi ridicate și are loc cu lanțuri foarte scurte. Mai mult, reacția exotermă inversă RI + HI ® RH + I 2 are loc foarte ușor. Când alcanii sunt iodați, se formează și compuși nesaturați. De exemplu, la 685°C, etanul, reacționând cu iodul, formează 72% etilenă și 10% acetilenă. Aceleași rezultate au fost obținute cu propan, butan și pentan.
Reacția de fluorurare a alcanilor are loc la o viteză foarte mare, adesea explozivă, cu formarea tuturor derivaților polifluorurați posibili ai alcanului original. Energia eliberată în timpul fluorurarii alcanilor este atât de mare încât poate duce la descompunerea moleculelor de produs în radicali care încep lanțuri noi. Ca urmare, viteza de reacție crește ca o avalanșă și aceasta duce la o explozie chiar și la temperaturi scăzute. Particularitatea fluorurarii alcanilor este posibilitatea distrugerii scheletului de carbon de către atomi de fluor cu formarea CF 4 ca produs final cu alți halogeni, o astfel de reacție nu are loc.
Nitrarea alcanilor (reacția lui Konovalov) urmează, de asemenea, un mecanism radical: RH + NO 2 ® R· + HNO 2, R· + NO 2 ® RNO 2. Sursa de NO 2 este acidul azotic, care se descompune atunci când este încălzit. Reacția se desfășoară în soluție la temperaturi peste 150° C sau în vapori sub presiune de până la 10 atm și la o temperatură de 400 – 500° C. În acest din urmă caz, legăturile C–C din alcani sunt de asemenea rupte și un amestec de se formează nitroalcani.
Toți alcanii ard prin eliberarea de căldură, de exemplu: C 5 H 12 + 8O 2 ® 5CO 2 + 6H 2 O. Această reacție are loc, în special, în cilindrii motoarelor cu ardere internă. Pentru a preveni pătrunderea în atmosferă a resturilor de alcani nearși, în țevile de eșapament se folosește arderea lor catalitică (în același timp, CO este ars și oxizii de azot sunt transformați în azot inofensiv). Reacția oxigenului cu alcanii superiori (în parafină) are loc atunci când arde o lumânare. Alcanii gazoși, cum ar fi metanul, formează amestecuri explozive cu aerul. Astfel de amestecuri se pot forma în mine, precum și în clădirile rezidențiale din cauza unei scurgeri de gaz de uz casnic, dacă conținutul acestuia în aer ajunge la 5%.
Eforturile semnificative ale chimiștilor au vizat un studiu detaliat al reacției de oxidare la temperatură scăzută a alcanilor pentru a o opri în stadiul de formare a produselor intermediare valoroase - aldehide, cetone, alcooli, acizi carboxilici. Astfel, în prezența sărurilor Co(II) și Mn(II), butanul poate fi oxidat la acid acetic și parafina la acizi grași C12-C18. Oxidarea ciclohexanului produce caprolactamă, un monomer pentru producerea capronei și acid adipic.
O reacție industrială importantă este sulfoclorurarea fotochimică a alcanilor: o reacție radicalică comună în lanț cu Cl 2 și SO 2 cu formarea clorurilor de acid alcansulfonic RSO 2 Cl. Această reacție este utilizată pe scară largă în producția de detergenți. La înlocuirea clorului cu oxigen, are loc o reacție radicală în lanț de oxidare sulfonica a alcanilor cu formarea acizilor alcansulfonici R–SO 2 –OH. Sărurile de sodiu ale acestor acizi sunt utilizate ca detergenți și agenți de emulsionare.
La temperaturi ridicate, are loc descompunerea (piroliza) alcanilor, de exemplu: CH 4 ® C + 2H 2 (1000° C), 2CH 4 ® C 2 H 2 + 3H 2 (1500° C), C 2 H 6 ® C 2H4 +H2. Ultima reacție are loc la 500°C în prezența unui catalizator (Ni). În mod similar, din butan se poate obține 2-butenă CH 3 CH = CHCH 3, în același timp se formează un amestec de etilenă și etan. Spre deosebire de această reacție radicală, cracarea catalitică a alcanilor are loc printr-un mecanism ionic și servește la producerea de benzină din fracții mai grele de petrol. Când sunt încălziți în prezența acizilor Lewis, de exemplu, AlCl 3, are loc izomerizarea: alcanii neramificati (normali) sunt transformați în acizi ramificati cu același număr de atomi de carbon. Această reacție este de mare importanță practică pentru obținerea de combustibil de înaltă calitate ( cm. NUMĂR OCTANĂ). Dehidrogenarea alcanilor poate fi însoțită de închiderea inelului (dehidrociclizare). În cazul dehidrociclizării hexanului, produsul principal este benzenul.
Metanul la temperatură ridicată în prezența unui catalizator reacționează cu vaporii de apă și monoxidul de carbon (IV) pentru a forma gaz de sinteză: CH 4 + H 2 O ® CO + 3H 2, CH 4 + CO 2 ® 2CO + 2H 2. Gazul de sinteză este folosit pentru a produce carburanți și alcool metilic.
În ultimii ani, eforturile chimiștilor au vizat crearea de catalizatori care activează legăturile C–H în moleculele de alcan în condiții blânde. Unele microorganisme „pot” efectua astfel de reacții, ale căror enzime sunt capabile să „digere” chiar și parafina cu formarea de compuși proteici. Sarcina chimiștilor este să înțeleagă cum funcționează catalizatorii naturali și să modeleze reacțiile enzimatice care pot avea loc la temperaturi obișnuite. În acest caz, diverși compuși organometalici sunt utilizați ca catalizatori. De exemplu, în prezența unor compuși de platină, metanolul CH3OH poate fi obținut direct din metan și în prezența unui complex de trifenilfosfină Rh[(C6H5)3P] de rodiu asociat cu molecule de CO; În timpul reacției, moleculele de CO sunt introduse în legăturile C-H ale alcanilor pentru a forma aldehide.
Cicloalcanii au proprietăți chimice similare cu alcanii. Astfel, sunt inflamabile, pot fi halogenate printr-un mecanism radical, iar la temperaturi ridicate în prezența catalizatorilor sunt dehidrogenate - se desprind hidrogenul și se transformă în hidrocarburi nesaturate. După cum am menționat, ciclopropanul are proprietăți speciale. Spre deosebire de alcani, cicloalcanii sunt hidrogenați, atunci când inelul se deschide și se formează alcani, de exemplu: ciclo-C 3 H 6 + H 2 ® C 3 H 8 (reacţia are loc când este încălzită în prezenţa unui catalizator de platină). Pe măsură ce dimensiunea ciclului crește, reacția devine mai dificilă - astfel, ciclopentanul este deja hidrogenat (la pentan) cu mare dificultate și la temperaturi ridicate (300 ° C).
A fi în natură și a primi.
Principalele surse de alcani sunt petrolul și gazele naturale. Metanul reprezintă cea mai mare parte a gazelor naturale; de asemenea, conține cantități mici de etan, propan și butan. Metanul se găsește în emisiile din mlaștini și straturile de cărbune. Alături de omologii ușoare, metanul este prezent în gazele petroliere asociate. Aceste gaze sunt dizolvate în ulei sub presiune și sunt, de asemenea, situate deasupra acestuia. Alcanii reprezintă o parte semnificativă a produselor petroliere. Uleiul conține și cicloalcani - se numesc naftene (din greacă. nafta- ulei). Hidrații de gaz ai alcanilor, în principal metanul, sunt, de asemenea, răspândiți în natură; se găsesc în rocile sedimentare de pe continente și pe fundul oceanelor. Rezervele lor depășesc probabil rezervele cunoscute de gaze naturale și, în viitor, pot deveni o sursă de metan și cei mai apropiați omologi ai săi.
Alcanii se obțin și prin piroliza (cocsificarea) cărbunelui și hidrogenarea acestuia (producția de combustibil lichid sintetic). Alcanii solizi se găsesc în natură sub formă de depozite de ceară de munte - ozokerită, în învelișurile ceroase ale frunzelor, florilor și semințelor de plante și fac parte din ceara de albine.
În industrie, alcanii sunt produși prin hidrogenarea catalitică a oxizilor de carbon CO și CO 2 (metoda Fischer–Tropsch). În laborator, metanul poate fi obținut prin încălzirea acetatului de sodiu cu un alcali solid: CH 3 COONa + NaOH ® CH 4 + Na 2 CO 3 , precum și prin hidroliza unor carburi: Al 4 C 3 + 12H 2 O ® 3CH 4 + 4Al(OH)3. Omologii metanului pot fi obținuți prin reacția Wurtz, de exemplu: 2CH 3 Br + 2Na ® CH 3 –CH 3 + 2NaBr. În cazul dihaloalcanilor se obțin cicloalcani, de exemplu: Br–CH 2 –(CH 2) 4 –CH 2 Br + 2Na ® ciclo-C6H12+2NaBr. Alcanii se formează și în timpul decarboxilării acizilor carboxilici și în timpul electrolizei acestora.
Aplicarea alcanilor.
Ca combustibil sunt utilizați alcanii din benzină, kerosen, motorină și păcură. Alcanii mai mari se găsesc în uleiurile lubrifiante, vaselina și parafină. Un amestec de pentani izomeri și hexani se numește eter de petrol și este folosit ca solvent. Ciclohexanul este, de asemenea, utilizat pe scară largă ca solvent și pentru sinteza polimerilor (nailon, nailon). Ciclopropanul este utilizat pentru anestezie. Squalanul este un ulei lubrifiant de înaltă calitate, o componentă a preparatelor farmaceutice și cosmetice și un adsorbant în cromatografia gaz-lichid.
Alcanii servesc drept materii prime pentru producerea multor compuși organici, inclusiv alcooli, aldehide și acizi. Derivații de clor ai alcanilor sunt utilizați ca solvenți, de exemplu, triclormetan (cloroform) CHCI3, tetraclorură de carbon CCl4. Un amestec de alcani superiori - parafină este netoxic și este utilizat pe scară largă în industria alimentară pentru impregnarea recipientelor și materialelor de ambalare (de exemplu, cutii de lapte) și în producția de gumă de mestecat. Creioanele și partea superioară (lângă cap) a chibriturilor sunt impregnate cu parafină pentru o ardere mai bună. Parafina încălzită este utilizată în scopuri medicinale (terapie cu parafină). Oxidarea parafinei în condiții controlate în prezența catalizatorilor (săruri organice ale metalelor de tranziție) duce la producerea de produse care conțin oxigen, în principal acizi organici.
Ilya Leenson
Literatură:
Petrov A.A. Chimia alcanilor. M., Nauka, 1974
Azerbaev I.N. si etc. Sinteze pe bază de hidrocarburi petroliere. Alma-Ata, Știință, 1974
Rudakov E.S. Reacții ale alcanilor cu agenți oxidanți, complecși metalici și radicali în soluții. Kiev, Naukova Dumka, 1985
Parauşanu V. Producția și utilizarea hidrocarburilor. M., Chimie, 1987